Konduktometrie – eine elektrochemische Analysemethode
Elektrochemische Analysemethoden beruhen auf physikalischen oder chemischen Vorgängen, die in elektrochemischen Zellen unter Ladungsaustausch an den Elektroden ablaufen. Sie werden meist zur quantitativen Analyse wässriger Lösungen genutzt.
Zu diesen Analysemethoden gehören u.a. Potenziometrie, Konduktometrie und elektrophoretische Verfahren.
Bei allen Verfahren werden elektrische Größen z. B. die Zellspannung, Leitfähigkeit oder die Wanderungsgeschwindigkeit von Teilchen gemessen. Diese stehen in Zusammenhang mit der Art und der Konzentration der zu bestimmenden Substanz, die Analyt genannt wird. Bei der konduktometrischen Titration wird die Änderung des Leitwerts einer Analysenlösung während der Zugabe einer geeigneten Maßlösung gemessen. Auf diese Weise kann der Äquivalenzpunkt der Titration sehr genau bestimmt werden.
Die Konduktometrie ist eine quantitative Analysenmethode, bei der man den elektrischen Leitwert L bzw. den Ohmschen Widerstand R als Maß für die Konzentration der Probelösung verfolgt. Der elektrische Leitwert (Einheit: Siemens) ist dem elektrischen Widerstand (Einheit: Ohm) umgekehrt proportional.
Die elektrische Leitfähigkeit einer Elektrolytlösung hängt sowohl von der Konzentration als auch von der Art der gelösten Ionen ab. So hat z. B. eine Lösung zweifach positiv geladener einen höheren Leitwert als eine Natriumsalzlösung gleicher Konzentration. Besonders hoch ist die Leitfähigkeit saurer und basischer Lösungen, da Oxonium- und Hydroxid-Ionen im elektrischen Feld 3 bis 5 mal schneller wandern als andere hydratisierte Ionen.
Diesen besonderen Ladungstransport nutzt man bei der konduktometrischen Säure-Base-Titration. Der Leitwert wird dadurch bestimmt, dass zwei gleiche inerte Elektroden in die Elektrolytlösung getaucht und eine Wechselspannung angelegt wird, damit keine Abscheidung des Analyten stattfinden kann. Durch Auftragen des Leitwertes gegen das Volumen an verbrauchter Maßlösung wird die Titrationskurve erhalten.
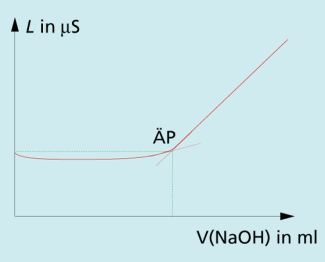
| a) konduktometrische Titration einer starken Säure mit einer starken Base: |
Bis zum Äquivalenzpunkt werden verbraucht und durch ersetzt. Da viel langsamer wandern als , sinkt der Leitwert des Elektrolyten insgesamt. Nach dem Aquivalenzpunkt läuft keine chemische Reaktion mehr ab. Die weitere Zugabe von NaOH lässt die Leitfähigkeit steigen (Bild 1).
| b) konduktometrische Titration einer schwachen Säure mit einer starken Base: |
-
Konduktometrische Titration einer starken Säure
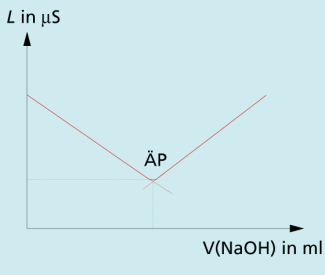
Die schwache Säure Essigsäure liegt nur zu einem geringen Teil dissoziiert vor. Deshalb ist der Leitwert zu Beginn der Titration deutlich niedriger als bei der Titration einer starken Säure vergleichbarer Konzentration. Die durch die Natronlauge verbrauchten werden zunächst durch Protolyse der Essigsäure nachgebildet, sodass der Leitwert durch die Zunahme der Konzentration an Natriumionen langsam ansteigt. Erst wenn die Essigsäure vollständig in Acetat-Ionen umgewandelt wurde, werden die nicht mehr abgepuffert. Die weitere Zugabe von Natronlauge führt nach dem Äquivalenzpunkt zu einem starken Anstieg des pH-Werts und damit der Leitfähigkeit (Bild 2).
Im Gegensatz zur Potenziometrie haben direktkonduktometrische Messungen kaum praktische Bedeutung. Das Hauptanwendungsgebiet ist die konduktometrische Titration.
-
Konduktometrische Titration einer schwachen Säure