Grundprinzip der Chromatografie
Bei der Chromatografie handelt es sich um ein physikalisches Trennverfahren, bei denen die Stofftrennung auf der unterschiedlichen Verteilung zwischen einer stationären und einer mobilen Phase, die nicht miteinander mischbar sind, beruht. Chromatografische Analyseverfahren dienen zur qualitativen und quantitativen Analyse.
Bei der Chromatografie handelt es sich um ein physikalisches Trennverfahren, bei denen die Stofftrennung auf der unterschiedlichen Verteilung der einzelnen Komponenten im Stoffgenmisch zwischen einer stationären und einer mobilen Phase, die nicht miteinander mischbar sind, beruht. Chromatografische Analyseverfahren dienen zur qualitativen und quantitativen Analyse.
Allen Arten der Chromatografie ist gemeinsam, dass das zu analysierende Stoffgemisch von einer beweglichen (mobilen) Phase, z. B. einem Lösungsmittel aufgenommen und an einer ruhenden (stationären) Phase vorbei transportiert wird. Aufgrund der unterschiedlichen Wechselwirkungen der einzelnen Koponenten mit der mobilen und der stationären Phase bewegen sie sich mit unterschiedlicher Geschwindigkeit durch die stationäre Phase und trennen sich so voneinander. Die Trennwirkung beruht auf Adsorptions-, Austausch- und Verteilungsvorgängen, die sich gegenseitig beeinflussen. Von Bedeutung ist dabei besonders die Polarität der einzelnen Phasen und der zu analysierenden Stoffe. Ein polarer Analyt wird an einer polaren stationären Phase weitaus stärker gebunden als ein unpolarer Analyt.
Teilchen werden als polar bezeichnet, wenn sie ein Dipolmoment besitzen. Polare Phasen enthalten besondere Strukturelemente wie OH-Gruppen, an denen sich polare Teilchen anlagern.
-
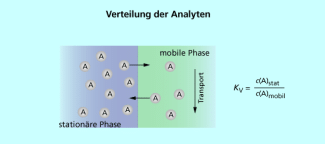
Verteilung des Analyten (A) zwischen mobiler und stationärer Phase
Die wichtigsten chromatografischen Analysenmethoden sind:
- Papierchromatografie
- Dünnschichtchromatografie (DC)
- klassische Säulenchromatografie (mit flüssiger mobiler Phase, LC)
- HPLC (Hochleistungsflüssigkeitschromatografie bzw. High Performance Liquid Chromatography)
- Gaschromatografie (GC)
- Ionenchromatografie (IC)
Die Verteilung des Analyten zwischen der stationären und der mobilen Phase wird durch das Verteilungsgleichgewicht beschrieben. Der Verteilungskoeffizient zwischen der stationären und der mobilen Phase charakterisiert dieses Gleichgewicht. Bei konstanter Temperatur und Druck hängt von den Eigenschaften der drei Stoffe (Analyt, stationäre und mobile Phase) und den sich daraus ergebenden Wechselwirkungen ab.
Der Verteilungskoeffizient bzw. der Verteilungssatz
wurde von W. NERNST (1864-1941) formuliert. Er gilt streng genommen nur für ideal verdünnte Lösungen.
Neben Verteilungsprozessen spielen auch noch Austauschprozesse und Adsorptions-Desorptionsprozesse eine wichtige Rolle in der Chromatografie. Oft treten diese Prozesse gleichzeitig auf.
Das Trennungsergebnis erhält man als Chromatogramm, das je nach Art der Chromatografie auf dem Papier, einer Dünnschicht-Platte oder in Form eines Diagramms vorliegt.
Chromatografische Trennverfahren werden zur qualitativen und quantitativen Analyse in der Kriminalistik, Umwelt-, Arzneimittel- und Lebensmittelanalytik angewendet. Selbst geringe Spuren von Giften, Dopingmitteln oder anderen Stoffen können chromatografisch eindeutig nachgewiesen werden.
Zu den einzelnen Methoden findet man weiterführende Informationen in anderen Beiträgen auf dieser CD.
-
Übersicht über die wichtigsten Methoden der Chromatografie

-
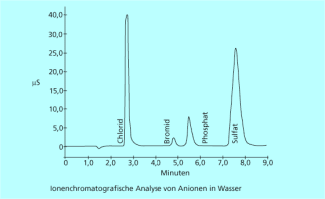
Gaschromatogramm
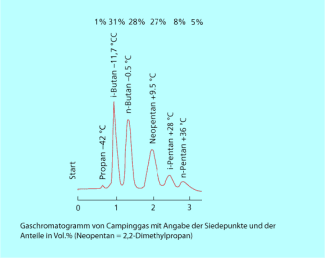
-
Ionenchromatogramm