Grundbausteine des Lebens – chemische Grundlagen
In der Biologie spielt das Element Kohlenstoff eine herausragende Rolle. Von besonderer Bedeutung ist dabei, dass Kohlenstoffatome vier Außenelektronen aufweisen. Der Bau des Kohlenstoffatoms erlaubt Bindungen mit vielen anderen Atomen. Von großer Relevanz sind in der Organik Atombindungen und zwischenmolekulare Kräfte.
Atombau
Chemische Elemente sind aus jeweils einer Atomart aufgebaut. Atome bestehen aus einem Atomkern und einer Atomhülle. Im Atomkern befinden sich eine für jede Atomart charakteristische Anzahl positiv geladener Protonen und eine Anzahl von Neutronen. Der Atomkern ist von einer Atomhülle aus negativ geladenen Elektronen umgeben. Ihre Gesamtzahl ist gleich der Zahl der Protonen.
Der Bau der Atome bestimmt die Stellung des Elements im Periodensystem der Elemente . Daher kann man dem Periodensystem Informationen zum Atombau entnehmen. Das Periodensystem wurde 1869 von dem russischen Chemiker DMITRIJ MENDELEEV (1834-1907) und vom deutschen Chemiker LOTHAR MEYER (1830-1895) unabhängig voneinander aufgestellt.
Die Atommasse wird durch die Masse des Kerns bestimmt. Sie setzt sich aus der Summe der Masse der Nucleonen (Protonen und Neutronen) zusammen, wobei die Atome eines Elements zwar immer die gleiche Anzahl von Protonen aufweisen, sich jedoch durch die Zahl der Neutronen unterscheiden können. Atome eines Elements mit unterschiedlicher Anzahl an Neutronen im Atomkern bezeichnet man als Isotope .
![]()
Da viele Isotope im Laufe der Zeit unter Abgabe von radioaktiver Strahlung zerfallen, kann ihr Anteil in einer Substanz zur geologischen oder archäologischen Altersbestimmung genutzt werden.
In biologischen Versuchen können sie zur Markierung (Tracer) eingesetzt werden.
In der Biologie spielt das Element Kohlenstoff eine herausragende Rolle. Von besonderer Bedeutung ist dabei, dass Kohlenstoffatome vier Außenelektronen aufweisen. Der Bau des Kohlenstoffatoms erlaubt Bindungen mit vielen anderen Atomen.
Bindungsarten
Freie Atome existieren nur unter Extrembedingungen. Ansonsten werden Aggregate aus Atomen, Molekülen oder Ionen gebildet. Nach der Art der Wechselwirkungen zwischen ihnen unterscheidet man verschiedene Bindungsarten.
Metallbindung
Nach dem Elektronengasmodell können die Außenelektronen der Metallatome im Gitter austreten. Geschieht dies, werden sie frei beweglich und bilden das sogenannte Elektronengas. Aus den Atomen werden kurzzeitig positiv geladene Metall-Ionen. Atome und Ionen wechseln sich ständig durch Abgabe bzw. Aufnahme von Elektronen ab. Der Zusammenhalt im Metallgitter (Metallbindung) beruht auf den elektrostatischen Anziehungskräften zwischen frei beweglichen Elektronen und positiv geladenen Metall-Ionen. Diese Bindungsart spielt in der Organik kaum eine Rolle.
Ionenbindungen
Ionenbindungen werden durch die elektrostatischen Anziehungskräfte zwischen unterschiedlich geladenen Ionen hervorgerufen. So ist im Ionenkristall ein positiv geladenes Ion stets von negativ geladenen Ionen umgeben und umgekehrt. Die elektrostatischen Anziehungskräfte wirken in alle Richtungen des Raums. (Kochsalzkristalle sind beispielsweise aus positiv geladenen Natrium-Ionen und negativ geladenen Chlorid-Ionen im Verhältnis 1:1 zusammengesetzt, Kaliumhydroxidkristalle aus positiv geladenen Kalium-Ionen und negativ geladenen Hydroxid-Ionen im Verhältnis 1:1.)
Atombindungen (Elektronenpaarbindungen, kovalente Bindung)
Zwischen verschiedenen Atomen werden gemeinsame Elektronenpaare gebildet. Je nach der Elektronegativität (EN) der beteiligten Atome, also der Kraft, mit der die Elektronen angezogen werden, ist die Bindung polar oder unpolar.
Bei der unpolaren Atombindung werden gemeinsame Elektronenpaare von beiden beteiligten Atomen gleichberechtigt genutzt, das Molekül ist nach außen neutral (z. B. Wasserstoffmolekül – H2). Bei der polaren Atombindung wird das Elektronenpaar stärker zu dem elektronegativeren Partner hingezogen, wodurch Ladungsschwerpunkte ausgebildet werden (Kohlenstoffdioxid – CO2; Wasser – H2O). Gleichen sich die Partialladungen durch die Raumstruktur der Moleküle nicht aus, liegen Dipolmoleküle vor (Wasser – H2O).
-
Dipolmoleküle
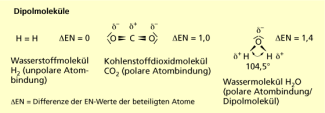
VAN-DER-WAALS-Kräfte
Diese zwischenmolekularen Kräfte beruhen einerseits auf der kurzzeitigen Umverteilung von Elektronen im Molekül, die durch Annäherung eines Dipols oder unpolarer Moleküle induziert wird (temporärer Dipol). Die wirkenden Kräfte sind verhältnismäßig gering. Stärkere zwischenmolekulare Anziehungskräfte wirken andererseits zwischen permanenten Dipolen bzw. zwischen Dipolen und Ionen.
Wasserstoffbrückenbindungen
Die Ausbildung von Wasserstoffbrückenbindungen beruht auf zwischenmolekularen Kräften. Ein gebundenes partiell positiv geladenes Wasserstoffatom tritt in Wechselwirkung mit einem partiell negativ geladenen Atom eines anderen Moleküls. Diese Bindungen treten u. a. zwischen Wassermolekülen (Abbildung 4) und zwischen Ethanolmolekülen auf.

