Lichtemission
Wenn durch Absorption von elektromagnetischer Strahlung ein höherer energetischer Zustand erreicht wird, dann kann diese Energie in verschiedenen Formen wieder abgegeben werden. Liegt die Wellenlänge der abgegebenen Energie im Bereich des sichtbaren Lichtes, spricht man von Lichtemission.
Die Lichtemission ist immer mit einer Veränderung des Energiezustandes verbunden. Welche Art der Energiezufuhr von außen notwendig ist, hängt vom Molekül ab und lässt sich mithilfe quantenchemischer Modelle berechnen.
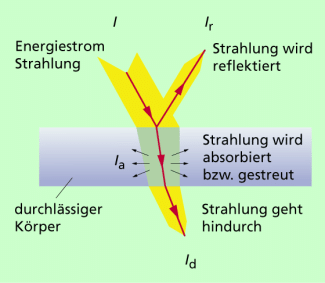
Die vom menschlichen Auge wahrnehmbare, elektromagnetische Strahlung mit Wellenlängen zwischen 400 und 800 nm, manchmal auch inklusive des ultravioletten und infraroten Bereiches, wird als Licht bezeichnet. Wie uns die unterschiedlichen Objekte in unserem Umfeld erscheinen, ob sie schwarz oder blau sind, ob glänzend oder stumpf, ist davon abhängig, wie sie die Wellen des auf sie auftreffenden Lichts verändern. Die Wechselwirkungen zwischen Licht und Materie sind sehr vielschichtig. So kann Licht von Körpern refektiert, absorbiert, gebrochen, gebeugt oder gestreut werden (Bild 2).
Wenn durch Absorption von elektromagnetischer Strahlung ein höherer energetischer Zustand erreicht wird, dann kann diese Energie in verschiedenen Formen wieder abgegeben werden (Bild 3). Liegt die Wellenlänge der abgegebenen Energie im Bereich des sichtbaren Lichtes, spricht man von Lichtemission.
Die Lichtemission ist immer mit einer Veränderung des Energiezustandes verbunden. Welche Art der Energiezufuhr von außen notwendig ist, hängt vom Molekül ab und lässt sich mithilfe quantenchemischer Modelle berechnen.
Das von Lichtquellen emittierte Licht besitzt eine spektrale Verteilung, ist also nicht monochromatisch.
-
Licht wird von einem lichtdurchlässigen Körper teils reflektiert, teils absorbiert und teils hindurchgelassen.
Lumineszenz
Die Lumineszenz ist durch die Anregung eines Elektrons in ein höheres Energieniveau und den anschließenden Übergang in ein unbesetztes energetisch tieferes Niveau gekennzeichnet. Die Energiedifferenz wird oft in Form von Licht abgegeben. Die frei werdende Energie kann auch strahlungslos, z. B. in Form von Wärme, abgegeben werden.
Nicht jedes Molekül ist also in der Lage, Phosphoreszenz- bzw. Fluoreszenzlicht auszustrahlen. Je nach Art der Energiezufuhr lassen sich die Lumineszenzerscheinungen einteilen:
- Chemolumineszenz : während einer Reaktion entsteht ein Molekül im angeregten Zustand und dieses kann in Folge seine Energie in Form von Licht abgeben (Geschieht dies in biologischen Systemen, dann spricht man von Biolumineszenz)
- Fotolumineszenz: optische Anregung des Elektrons (z. B. optische Aufheller in Waschmitteln)
- Thermolumineszenz: durch Zufuhr von Wärme wird ein Ladungsträger in einen angeregten, langlebigen, metastabilen Zustand überführt und von dort unter Aussendung von Licht relaxiert
- Radiolumineszenz: (radioaktive Strahlung) werden in ein geeignetes Material geschossen, welches dann unter Aussendung von Lumineszenzlicht relaxiert.
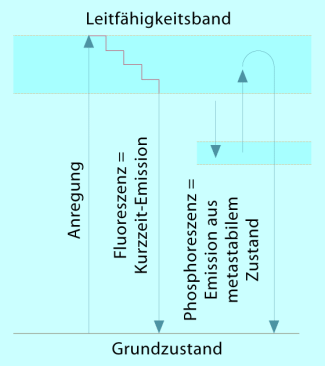
Phosphoreszenz und Fluoreszenz sind ebenfalls eine Form der Lumineszenz, der Lichtemission von Gasen, Flüssigkeiten und Festkörpern nach Energiezufuhr von außen. Die Unterscheidung beruht im wesentlichen in der Dauer der Lichtemission nach Energiezufuhr. Die Phosphoreszenz gehört zu den eher langsamen und/oder temperaturabhängigen Abklingprozessen. Das Leuchtphänomen tritt auch noch nach dem Ausschalten der Anregungslichtquelle auf, z. B. Leuchtzahlen auf Uhrenzifferblättern. Die Fluoreszenz hingegen ist zu den schnelleren Emissionsprozessen zu rechnen. Es erfolgt kein Nachleuchten. Wenn die Anregungslichtquelle ausgeschaltet ist, hört auch das Leuchten sofort auf.
Die Lichtemission bei Glühprozessen gehört nicht zur Lumineszenz.
-
Nach Anregung in ein höheres Energieniveau kann Energie in unterschiedlichen Formen wieder abgegeben werden.