Nomenklatur von Komplexverbindungen
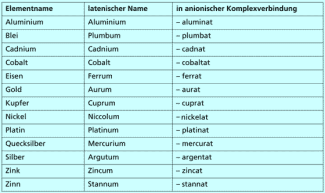
Für die Benennung von Komplexverbindungen hat die IUPAC bestimmte Regeln aufgestellt. Generell werden Komplexteilchen folgendermaßen benannt: Erst die Anzahl der Liganden, dann die Namen der Liganden, schließlich der Name des Zentralteilchens mit seiner Oxidationszahl. Handelt es sich um ein anionisches Komplexteilchen, erhält es außerdem die Endung –at, und man verwendet den lateinischen Namen für das Zentralteilchen.
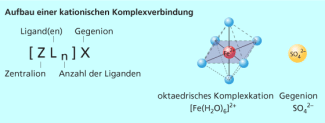
Komplexe sind Verbindungen, die aus einem Zentralion bzw. Zentralatom und mehreren Liganden, bei denen es sich um Moleküle oder um Ionen handeln kann, aufgebaut sind. Die Zahl der Liganden, die an das Zentralion gebunden sind, wird als Koordinationszahl bezeichnet und beträgt meistens 2, 4 oder 6.
Die Bindung zwischen Zentralion und Liganden wird koordinative Bindung genannt. Sie kommt durch eine Donor-Akzeptor-Wechselwirkung zwischen Lewis-Säure (Zentral-Ion) und Lewis-Basen (Liganden) zustande.
Nomenklatur von Komplexverbindungen
Für die Nomenklatur von Komplexverbindungen wurden von der IUPAC eigene Regeln entwickelt. Um Komplexverbindungen von anderen Verbindungen zu unterscheiden, werden Komplexteilchen, d. h. die Einheit aus Zentralion und Liganden, in eckige Klammern gesetzt. Das Zentralion steht dabei in der Formel vor den Liganden.
Bei geladenen Komplexteilchen sind immer Gegenionen vorhanden, sodass die gesamte Komplexverbindung elektrisch neutral ist. Diese Gegenionen gehören nicht zum eigentlichen Komplexteilchen, sie stehen daher nicht in der eckigen Klammer (Bild 2).
Für den Namen einer Komplexverbindung ist zunächst wichtig, ob das zu benennende Komplexteilchen als Kation oder als Anion vorliegt, denn das Kation steht bei salzartigen Verbindungen immer an erster Stelle (z. B. Natriumchlorid, Calciumoxid).
-
Beispiele für Komplexverbindungen
Verbindungen mit kationischen Komplexteilchen
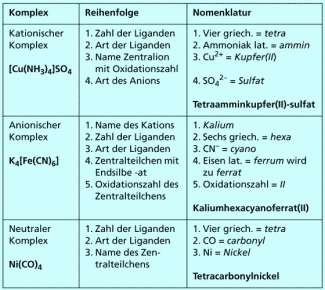
Der Name einer Verbindung mit einem kationischen Komplexteilchen hat folgende Bestandteile:
| 1. | Name des Komplexteilchens (kationisch), bestehend aus | ||
| a) | Anzahl der Liganden | ||
| b) | Namen der Liganden | ||
| c) | Name des Zentralteilchens mit Oxidationszahl | ||
| 2. | Name der Gegenionen (Anionen) | ||
Das kationische Komplexteilchen steht vorne, der Name der Verbindung beginnt daher mit der Anzahl der Liganden. Diese wird durch griechische Zählwörter ausgedrückt:
| Zahl der Liganden | 1 | 2 | 3 | 4 | 5 | 6 |
| Zahlwort | (mono) | di | tri | tetra | penta | hexa |
-
Aufbau einer kationischen Komplexverbindung
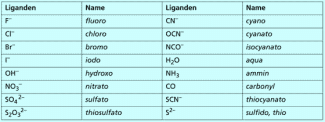
Die Liganden (Bild 4) bilden den nächsten Namensbestandteil. Handelt es sich um Anionen, so erhalten sie die Endung -o (z. B. chloro, hydroxo). Bei neutralen Liganden ändert sich der Name nicht (z. B. Ethylendiamin). Manche häufig vorkommenden Liganden haben eigene Namen (z. B. aqua, ammin).
Enthält ein Komplexteilchen mehrere unterschiedliche Liganden, werden sie in alphabetischer Reihenfolge genannt. Die griechischen Zählwörter, die die Zahl der Liganden angeben, werden dabei nicht berücksichtigt, also kommt beispielsweise „trichloro“ vor „dihydroxo“.
Auf die Liganden folgt der Name des Zentralteilchens mitsamt seiner Oxidationszahl, die als römische Ziffer in Klammern steht.
Beispiele: Silber(I), Kupfer(II), Cobalt(III).
Die Benennung des Komplexteilchens, also desjenigen Teils der Formel, der in eckigen Klammern steht, ist nun abgeschlossen. Für den Namen der gesamten Verbindung fehlen noch die Anionen, die die Gegenionen darstellen, sie werden - wie auch sonst bei Ionenverbindungen üblich - hinten angehängt. Die Anzahl der Anionen wird üblicherweise nicht genannt, weil sie sich aus der Summe der Ladung von Zentralteilchen und Liganden ergibt.
Die Komplexverbindung erhält also folgenden Namen: Die Zahl der Liganden ist 4, d. h. griechisch tetra. Der Ligand ist in unserem Beispiel = ammin. Es folgt das Zentralteilchen, Kupfer, und dessen Oxidationszahl (II). Schließlich wird das Anion, Sulfat, benannt.
Der Name unserer Beispielverbindung lautet somit:
Tetraamminkupfer(II)-sulfat.
Weitere Beispiele für Komplexverbindungen mit kationischen Komplexteilchen sind:
Verbindungen mit anionischen Komplexteilchen
Die Benennung von Verbindungen mit anionischen Komplexteilchen erfolgt in einer etwas anderen Reihenfolge:
| 1. | Name der Gegenionen (Kationen) | ||
| 2. | Name des Komplexteilchens (anionisch), bestehend aus | ||
| a) | Anzahl der Liganden | ||
| b) | Namen der Liganden | ||
| c) | Lateinischer Name des Zentralions mit der Endung -at und seine Oxidationszahl | ||
-
Wichtige Liganden
Im Vergleich zu kationischen Komplexen gibt es zwei wesentliche Unterschiede. Erstens steht das Komplexteilchen als Anion nun an zweiter Stelle, zweitens tragen anionische Komplexteilchen die Endung -at, so wie wir das von der Benennung mehratomiger Anionen (z. B. Sulfat, Carbonat) kennen, und das Zentralteilchen wird mit seinem lateinischen Namen genannt (Bild 5).
Die Nomenklatur für die Verbindung leitet sich wie folgt ab:
Zunächst wird das Kation, hier Kalium, benannt. Es folgen die Zahl (6, hexa) und die Art der Liganden. In unserem Beispiel sind es Cyanid-Anionen, also cyano. Danach werden das Zentralteilchen, Eisen (Ferrum), die Endsilbe -at und die Oxidationszahl des Zentralions (III) genannt, sodass sich ergibt:
Kalium-hexacyanoferrat(III)
Weitere Beispiele sind:
Elektrisch neutrale Komplexe
Bei Neutralkomplexen erfolgt die Bezeichnung entsprechend der Nomenklatur von kationischen Komplexteilchen durch Angabe der Zahl und Art der Liganden sowie des Zentralteilchens. Die eckige Klammer kann bei elektrisch neutralen Komplexen entfallen, ebenso die Oxidationszahl des Zentralteilchens.
-
Benennung von Metallionen in anionischen Komplexen