Organische Komplexbildner
Organische Liganden haben aufgrund der hohen Stabilität der Komplexe, die sie bilden, eine große Bedeutung. Oft sind organische Liganden mehrzähnig, d. h. sie können gleichzeitig mehrere Bindungen zu einem Zentralion ausbilden. Die enstehenden Chelatkomplexe sind stabiler als Komplexe mit vergleichbaren einzähnigen Liganden.
Wichtige, in der Natur vorkommende Komplexe mit organischen Liganden sind z. B. Hämoglobin, Chlorophyll und Vitamin B 12. In der analytischen Chemie findet insbesondere Ethylendiamintetraessigsäure (EDTA) als Ligand Verwendung.
Komplexe sind metallionenhaltige Verbindungen, die aus einem oder mehreren Zentralion/en und den Liganden bestehen, welche die Ligandenhülle bilden. Die chemische Bindung in Komplexen wird als koordinative Bindung bezeichnet.
Bei den Liganden kann man anorganische und organische unterscheiden.
![]()
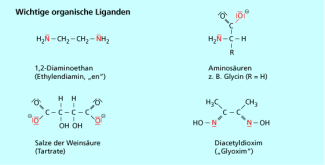
Die Liganden lassen sich weiterhin in einzähnige und mehrzähnige unterteilen, je nachdem wie viele Atome des Liganden zur Komplexbildung befähigt sind. Einzähnige Liganden sind z. B. Chlorid, Cyanid, Wasser oder 1-Aminoethan, sie können jeweils nur eine Bindung zum Zentralatom ausbilden. Mehrzähnige Liganden besitzen mehrere Atome, mit denen sie gleichzeitig ein Metallatom komplexieren können. Es handelt sich bei ihnen häufig um organische Moleküle wie 1,2-Diaminoethan oder Aminosäuren (Bild 2).
Mehrzähnige Liganden legen sich wie „Scheren“ um die Zentralionen und werden deshalb Chelatbildner oder Chelatliganden genannt (griech. chelae = Krebsscheren). Die Atome, die die koordinative Bindung zum Zentralatom ausbilden, müssen in einem geeigneten räumlichen Abstand zueinander stehen, um das Metallion komplexieren zu können. Meist bilden der Ligand und das Zentralion Fünf- oder Sechsringe, die energetisch besonders stabil sind.
Der Chelateffekt
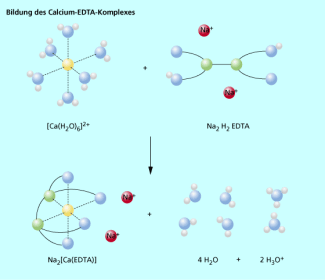
Chelatkomplexe sind stabiler als vergleichbare Komplexe mit einzähnigen Liganden. Diese Erscheinung wird Chelateffekt genannt und ist kinetisch und thermodynamisch bedingt. An folgendem Beispiel der Komplexbildung von Calcium und dem Dinatriumsalz der Ethylendiamintetraessigsäure (Edetinsäure) wird dies erläutert:
![]()
-
Einige wichtige organische Komplexbildner mit zwei und mehr Haftatomen
Die Wassermoleküle werden durch Dinatriumedetat aus dem Komplex verdrängt.
Da hierbei mehr Moleküle und Ionen freigegeben als neu gebunden werden, steigt die Entropie des Systems an. Dies begünstigt die Reaktion und bedeutet einen thermodynamischen Stabilisierungseffekt. Chelatliganden stabilisieren den Chelatkomplex auch kinetisch, da diese wesentlich schlechter vom Zentralion dissoziieren als einzähnige Liganden. Damit der Chelatbildner vom Metallion dissoziieren kann, müssen alle Bindungen des Liganden zum Zentralatom in einem kurzen Zeitraum gelöst werden. Dies ist wesentlich unwahrscheinlicher als der eine Bindungsbruch bei einzähnigen Liganden.
Organische Liganden
Wichtige Chelatbildner, die in der analytischen Chemie verwendet werden, sind Ethylendiamintetraessigsäure (EDTA), bzw. ihr Dinatriumsalz, Ethylendiamin (Diaminoethan, „en“), Oxinat (8-Hydroxychinolin), Diacetyldioxim („Glyoxim“) und Weinsäure bzw. ihre Salze, die Tartrate.
EDTA (N,N,N',N'-Tetracarboxyethyl-1,2-diaminoethan)
Für EDTA sind verschiedene Namen im Umlauf, z. B. Ethylendiamintetraessigsäure und Edetinsäure. Die Abkürzung EDTA rührt von der englischen Bezeichnung ethylendiaminetetraacetic acid her.
Als Komplexbildner wird in der Regel das Dinatriumsalz verwendet, da es in Wasser wesentlich besser löslich ist als die Säure und deshalb einfacher bei analytischen Techniken verwendbar ist.
Es ist auch unter den Namen Natriumedetat, Dinatrium-ethylendiamin-tetraacetat oder Komplexon III bekannt.
Obwohl sich die Säure und ihr Dinatriumsalz in ihren chemischen Eigenschaften unterscheiden, werden beide von Chemikern in der Umgangssprache nur „EDTA“ genannt.
Das Dinatriumsalz komplexiert viele Metallionen, insbesondere zweiwertige Ionen wie EDTA kann sechs koordinative Bindungen ausbilden, was einer oktaedrischen Koordination des Metallions entspricht. Vier Bindungen kommen durch die Carboxy-Gruppen zustande, zwei durch die freien Elektronenpaare der Stickstoffatome. EDTA reagiert im Verhältnis 1:1 mit den Metallionen.
-
Bildung des Calcium-EDTA-Komplexes
Ethylendiamin (1,2-Diaminoethan, „en“)
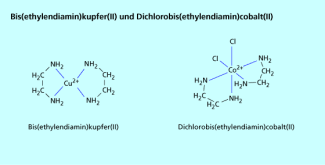
1,2-Diaminoethan ( Ethylendiamin ) ist ein einfacher zweizähniger organischer Komplexbildner. Es ist der einfachste Brückenligand, der einen energiearmen Fünfring bildet. Mit vielen Metallionen reagiert Ethylendiamin im Verhältnis 2:1, z. B. mit Kupfer (Bild 4). Tritt es als Ligand bei Komplexen mit höheren Koordinationszahlen auf, treten oftmals nur zwei Moleküle „en“ pro Metallion in den Komplex ein, weitere freie Bindungsstellen werden durch Wasser oder andere Liganden besetzt, z. B. (Bild 4). Derartige Komplexe sind chiral und optisch aktiv.
-
Bis(ethylendiamin)kupfer(II) und Dichloro-bis(ethylendiamin)cobalt(II)
Diacetyldioxim (2,3-Butandiondioxim, Dimethylglyoxim, „Glyoxim“)
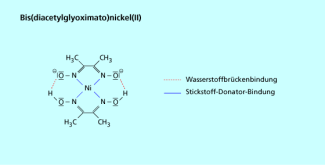
Diacetyldioxim ist ein sehr nützlicher Chelatbildner, denn viele seiner Komplexe haben eine charakteristische Eigenfärbung und dienen daher zum qualitativen und quantitativen Nachweis von Metallionen. Bestes Beispiel ist das rotgefärbte Bis(diacetylglyoximato)nickel(II) (Nickeldimethylglyoxim, Bild 5), welches noch in einer Verdünnung von nachweisbar ist. Als Komplex mit Diacetyldioxim lassen sich u. a. quantitativ durch fotometrische Bestimmung sehr gut nachweisen.
-
Der rote Bis(diacetylglyoximato)nickel(II)-Komplex dient zum Nachweis von Nickel.
Komplexe
Metallionen können auch durch die KohlenstoffElektronen ungesättigter oder aromatischer Verbindungen komplexiert werden, sodass Komplexe entstehen. Hierbei entsteht die Bindung zwischen den Komplexbestandteilen durch die Überlappung der Elektronenorbitale des Aromaten mit den leeren Orbitalen des Zentralions. Ferrocen (Bis (cyclopentadienyl)eisen(II), Bild 6) ist der bekannteste Vertreter dieser aromatischen Komplexe, welche auch als Sandwich-Verbindungen bezeichnet werden. Ferrocen und andere Komplexe werden als Katalysatoren, z. B. zur Herstellung von Kunststoffen, verwendet.
-
Ferrocen kann durch verschiedene Schreibweisen dargestellt werden.
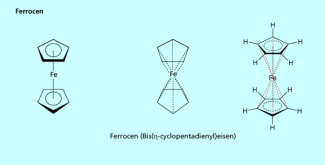
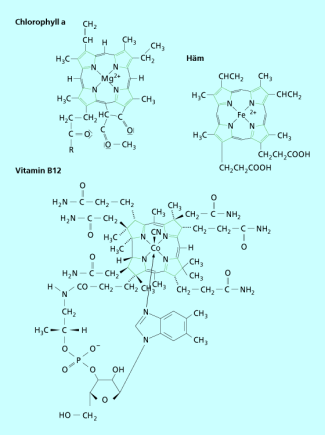
Wichtige natürliche Komplexe
Drei in der Natur vorkommende Komplexe mit außerordentlicher Bedeutung sind Hämoglobin, Chlorophyll (Blattgrün) und Vitamin B12 (Bild 7). Hämoglobin ist der rote Blutfarbstoff und wesentlich für die Atmung. Es transportiert Sauerstoff von der Lunge zu den Muskeln und anderen Geweben, die Sauerstoff benötigen, und von dort Kohlenstoffdioxid zur Lunge, wo es ausgeschieden wird.
Chlorophyll ist für die grüne Farbe von Pflanzen verantwortlich und ermöglicht die Fotosynthese, bei der unter Einwirkung von Sonnenlicht Kohlenstoffdioxid und Wasser in Kohlenhydrate und Sauerstoff umgewandelt werden.
Vitamin B12 (Cyanocobalamin) ist für die Entwicklung der roten Blutkörperchen (Erythrocyten) notwendig, außerdem für die Funktion des Nervensystems. Es kommt in Leber, aber auch in anderen tierischen Produkten wie Eiern, Fleisch oder Milch vor. Pflanzen enthalten praktisch kein Vitamin B12, weshalb insbesondere Vegetarier durch Vitamin-B12-Mangel gefährdet sind.
Viele Blütenfarbstoffe sind ebenfalls Komplexverbindungen.
Anwendungsgebiete von organischen Liganden
Das große Anwendungsspektrum organischer Chelatbildner ergibt sich daraus, dass die gebildeten Chelatkomplexe sehr hohe Stabilitätskonstanten aufweisen, also sehr effektiv Metallionen gebunden werden.
In der chemischen Analytik (Komplexometrie) dienen Chelatliganden zur quantitativen Analyse von Metallionen. Aufgrund der hohen Molmassen der Liganden lassen sich entstehende Komplexe gravimetrisch leicht bestimmen. Da viele Komplexe farbig sind, kann eine Auswertung auch fotometrisch erfolgen.
Weitere Anwendungsmöglichkeiten gibt es in der Nahrungsmittelindustrie, zur Wasserbehandlung (Metallionen-Entfernung), zur Entgiftung bei Schwermetallvergiftungen, zur Maskierung von Metallionen und bei der Herstellung von Kosmetika und Seifen. Ebenso werden organische Komplexbildner beim schonenden Beizen von Metalloberflächen, zur Herstellung von Farblacken (z. B. Alizarin S) und in der Bioanalytik als Nachweisreagenzien für Kohlenhydrate (Benedict-Probe) und Peptide (Biuret-Reaktion) verwendet.
-
Wichtige, in der Natur vorkommende Komplexe sind Häm (vom Hämoglobin), Chlorophyll und Vitamin B12 (Cobalamin).
Suche nach passenden Schlagwörtern
- mehrzähnige Liganden
- Organische Liganden
- Chlorophyll
- EDTA
- Koordinative Bindung
- Chelateffekt
- Ethylendiamin
- Zähnigkeit
- Blütenfarbstoffe
- Diacetyldioxim
- Sandwichverbindungen
- Hämoglobin
- Komplexe
- einzähnige Liganden
- Zentralion
- Chelate
- Ferrocen
- Anorganische Liganden
- Chelatbildner
- Ethylendiamintetraessigsäure
- Vitamin B12
- Liganden

