Polymerisation
Eine der wichtigsten Reaktionsarten, durch die Kunststoffe gebildet werden können, ist die Polymerisation. Darunter versteht man eine sich vielfach wiederholende gleichschrittige Reaktionsfolge – Kettenreaktion genannt, bei der sich einfache Ausgangsstoffe (Monomere) über reaktive Doppelbindungen miteinander verbinden. In der stark exothermen Reaktion werden keine Nebenprodukte abgespalten.
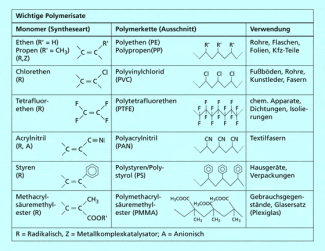
Wichtige Kunststoffe, die durch Polymerisation hergestellt werden, sind Polyethen (PE), Polypropen (PP), Polyvinylchlorid (PVC), Polystyrol (PS), Polytetrafluorethen (PTFE), Polyacrylnitril (PAN) und Polymethacrylsäuremethylester (PMMA).
Die Polymerisation ist eine der Synthesearten zur Herstellung von Polymeren. Damit sie möglich ist, müssen die Monomere mindestens eine Doppelbindung enthalten, über die sie in einer Kettenreaktion verknüpft werden. Dabei finden keinerlei Umlagerungen statt wie bei der Polyaddition, und es werden auch keine Nebenprodukte abgespalten wie bei der Polykondensation. Durch Polymerisation werden viele wichtige Kunststoffe des täglichen Gebrauchs hergestellt (Bild 2).
Um eine Polymerisation einzuleiten, muss zunächst die Doppelbindung des Monomers aktiviert werden. Dies kann auf verschiedenen Wegen erreicht werden: Einerseits, indem Energie zugeführt wird, z. B. als Wärme, durch Bestrahlung oder durch Ultraschall, andererseits auf chemischem Wege durch Verwendung stofflicher Initiatoren, die sich leicht zu Radikalen oder reaktiven Ionen anregen lassen und so die Polymerisation starten. Von technischem Interesse sind insbesondere radikalbildende Initiatoren, wie Peroxide und Azoverbindungen sowie ionische Initiatoren. Zunehmend gewinnen Metall-Komplex-Initiatoren an Bedeutung, da sich mit ihrer Hilfe eine ausreichende Kontrolle der stereochemischen Abläufe und somit der Eigenschaften des Reaktionsproduktes erreichen lässt.
Je nach Art des verwendeten Initiators verläuft die Polymerisation nach verschiedenen Mechanismen. Man unterscheidet die radikalische, die kationische und die anionische Polymerisation, außerdem die stereoselektive Polymerisation, die mithilfe von Metall-Komplex-Katalysatoren durchgeführt wird.
-
Wichtige Polymerisate
Radikalische Polymerisation
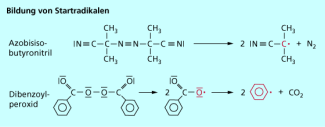
Radikale, also reaktive Teilchen, die ein freies, ungepaartes Elektron besitzen, sind die Initiatoren der radikalischen Polymerisationen. Solche Radikale werden in der Regel in einem der eigentlichen Reaktion vorgelagerten Schritt durch Einwirkung von sichtbarem Licht oder anderer energiereicher Strahlung bzw. Wärme auf leicht spaltbare Peroxide oder Azoverbindungen gewonnen (Bild 3). Im Labor greift man dafür häufig auf Dibenzoylperoxid (DBO) oder Azobisisobutyronitril (AIBN) zurück, während im industriellen Maßstab aus wirtschaftlichen Gründen preiswertere Verbindungen verwendet werden.
Das gebildete Startradikal löst in der Folge eine Kettenreaktion aus, die im Wesentlichen durch drei Schritte gekennzeichnet ist:
1. | In der Startreaktion , die auch als Kettenstart bezeichnet wird, spaltet das Startradikal die Doppelbindung des Monomers, indem es sich an dieselbe addiert und so ein neues Radikal bildet. |
2. | Dieses neue Radikal reagiert in der nun folgenden Kettenwachstumsreaktion mit einem weiteren Monomer, wobei wieder ein Radikal entsteht, das erneut mit einem Monomer reagiert. |
3. | Der Wachstumsprozess endet erst, wenn in der Abbruchreaktion zwei Radikale ihre Radikaleigenschaft verlieren und somit keine weitere Wachstumsreaktion mehr möglich ist. Dies kann auf zwei Arten geschehen: Zum einen können die beiden Radikale miteinander kombinieren, was als Rekombination bezeichnet wird, zum anderen kann eine Disproportionierung , stattfinden, bei der durch Übergang eines Wasserstoffatoms aus den beiden Radikalen ein Alkan und ein Alken gebildet werden. |
Da die Abbruchreaktionen rein statistisch erfolgen, bilden sich Makromoleküle unterschiedlicher Kettenlänge.
-
Bildung von Startradikalen
Als Monomere , die üblicherweise in Polymerisationsreaktionen eingesetzt werden, dienen Ethen oder Derivate des Ethens, bei dem ein oder mehrere Wasserstoffatome durch andere Atome oder Atomgruppen ersetzt sind. Je nach eingesetztem Monomer erhält man unterschiedliche Kunststoffe, wobei der prinzipielle Ablauf der Kettenreaktion gleich bleibt. Man kann auch verschiedene Monomere einsetzen, woraus dann Mischpolymere bzw. Copolymere gebildet werden.
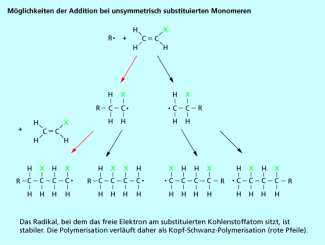
Meistens ist bei den Monomeren nur ein einziges Wasserstoffatom durch ein anderes Atom oder durch eine Atomgruppe ersetzt, sie sind daher an den Doppelbindungen unsymmetrisch substituiert. Im Prinzip können daher bei der Reaktion mit einem Radikal zwei unterschiedliche Produkte entstehen, je nachdem, ob das Radikal eine Bindung zum substituierten oder zum nicht substituierten Kohlenstoffatom ausbildet. Tatsächlich ist aber das Additionsprodukt, bei dem das substituierte Kohlenstoffatom das freie Elektron trägt, stabiler, weshalb die Addition normalerweise in der sogenannten Kopf-Schwanz-Stellung erfolgt (Bild 4). In der Polymerkette wechseln sich daher substituierte und unsubstituierte Kohlenstoffatome ab.
Reaktionsbedingungen und Polymereigenschaften
Der Verlauf der Polymerisation wird in hohem Maße durch den Einsatz spezieller Katalysatoren beeinflusst, aber auch die Temperatur der exothermen Reaktion steuert die Eigenschaften des Polymers.
-
Bei unsymmetrisch substituierten Monomeren gibt es theoretisch mehrere Möglichkeiten der Addition.
Kettenübertragung
Insbesondere bei höheren Reaktionstemperaturen sind Kettenübertragungsreaktionen häufig. Das wachsende Radikal spaltet mitten aus einer anderen Kette ein Wasserstoffatom ab, sodass ein neues Radikal entsteht, das die Kettenreaktion fortführen kann. Im Unterschied zu den beim Kettenstart und beim Kettenwachstum gebildeten Radikalen befindet sich das reaktive Kohlenstoffatom mit dem ungepaarten Elektron hier in der Mitte der Kette (Bild 5). Reagiert dieses Radikal mit Monomeren, entstehen unerwünschte Verzweigungen im Polymer.
-
Entstehung einer Kettenverzweigung

Regelung der Kettenlänge bei der Polymerisation
Die Kettenlänge der gebildeten Monomere kann durch die Menge der verwendeten Startersubstanz ebenso wie durch die Temperatur beeinflusst werden. Je höher die Temperatur bzw. je mehr Startradikale zur Verfügung stehen, um so schneller verläuft die Reaktion, und entsprechend kürzer werden die gebildeten Ketten.
Werden die Ketten zu lang, besteht die Gefahr eines explosiven Verlaufs der Polymerisation, da mit wachsender Kettenlänge die Viskosität des Polymerisates zunimmt und daher die Reaktionswärme nur schlecht abgeführt werden kann.
Durch Zusatz geeigneter Inhibitoren oder Regler kann die Kettenlänge ebenfalls gezielt beeinflusst werden. Regler sind Stoffe, die als Ladungsüberträger wirken. So können Thiole ein Wasserstoffatom auf eine wachsende Kette übertragen und das Wachstum stoppen. Dabei entsteht ein neues Radikal, das wiederum eine Kette starten kann (Bild 6).
Inhibitoren sind Stoffe wie Amine, Phenole und Chinone, die relativ stabile und damit reaktionsträge Radikale bilden, die die wachsende Kette nicht fortpflanzen können. Generell eignen sich ungesättigte Substanzen mit hoher Elektronendichte (insbesondere aromatische Systeme) als Inhibitoren, da der Elektronenmangel eines entstehenden Radikals durch mesomere oder induktive Effekte stabilisiert wird. Durch Disproportionierung oder Rekombination werden die Inhibitoren weiter stabilisiert.
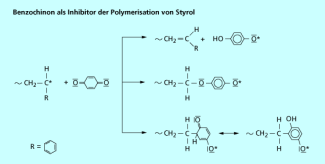
Ein Beispiel für einen Inhibitor ist p-Benzochinon (1,4-Dihydroxybenzen). Reagiert die wachsende Kette an Stelle eines Monomers mit einem p-Benzochinonmolekül, können drei unterschiedliche Radikale gebildet werden. Diese werden als aromatische Radikale alle durch Mesomerie stabilisiert und sind daher reaktionsträge (Bild 7).
-
Thiole dienen als Regler des Kettenwachstums.

-
Funktionsweise von Inhibitoren
Polymerisation mit Metallkomplex-Katalysatoren
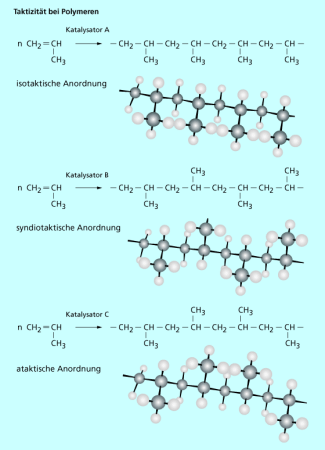
Durch spezielle Katalysatoren lässt sich insbesondere die Taktizität steuern, die wesentlichen Einfluss auf die Eigenschaften eines Polymers hat. Sie beschreibt die Anordnung der Substituenten relativ zur Polymerkette. In der Kette sind alle Kohlenstoffatome , was bedeutet, dass die vier Atome, an die sie jeweils gebunden sind, tetraedrisch angeordnet sind. Für die Anordnung der Substituenten in der Molekülkette gibt es daher insgesamt drei Möglichkeiten. Von einem isotaktischen Polymer spricht man dann, wenn alle Substituenten in dieselbe Richtung zeigen. Zeigen sie regelmäßig abwechselnd in beide Richtungen, nennt man dies syndiotaktisch. Eine unregelmäßige Anordnung der Substituenten bezeichnet man als ataktisch (Bild 8).
Normalerweise entstehen bei einer Polymerisation ataktische Produkte ohne regelmäßige Anordnung der Substituenten. Die stereospezifische Synthese, bei der syndiotaktische oder isotaktische Polymere gebildet werden, wurde erst durch die Entdeckung spezieller metallorganischer Katalysatoren durch K. W. ZIEGLER und G. NATTA möglich. Vereinfacht gesagt, halten diese Katalysatoren die entstehende Polymerkette und das jeweils neu hinzukommende Monomer so fest, dass es nur auf eine ganz bestimmte Art an die Kette angebaut werden kann, wodurch sich eine regelmäßige Anordnung der Substituenten ergibt.
Das Prinzip wird auch als Koordinationskatalyse bezeichnet. Weitere Einzelheiten dazu findet man im Beitrag "Polyethylen".
-
Die Taktizität von Polymeren hat Einfluss auf ihre Eigenschaften.
Ionische Polymerisation
Eine Polymerisation kann auch durch Ionen initiiert werden. Man unterscheidet zwischen kationischer und anionischer Polymerisation.
Für die kationische Polymerisation werden als Initiatoren starke Brönsted-Säuren oder Lewis-Säuren wie Bortrifluorid () bzw. Aluminiumtrichlorid () in Verbindung mit Wasser eingesetzt. Bei der Hydrolyse der Lewis-Säuren Bortrifluorid und Aluminiumtrichlorid werden Oxoniumionen, , gebildet. Die Reaktion wird durch die Addition eines Protons an eine Doppelbindung des Monomers gestartet, wobei ein Carbo-Kation entsteht, das mit einem weiteren Alkenmolekül reagiert und so das Kettenwachstum sichert. Durch Abspaltung eines Protons oder durch Anlagerung eines Anions (aus dem Startkatalysator) wird das Kettenwachstum abgebrochen. Man setzt dazu auch gezielt Basen oder geeignete Anionen zu. Ein wichtiges Produkt der kationischen Polymerisation ist Butylkautschuk, ein Copolymer aus 2-Methylpropen und 0,5 - 5 % Isopren.
![]()
Die anionische Polymerisation wird durch Addition einer starken Base oder eines reaktionsfähigen Metalls wie Natrium ausgelöst, wobei durch Anlagerung der Base an ein Monomer oder durch Elektronenübertragung ein Carbanion entsteht, welches die Kettenreaktion fortsetzt. Man muss folglich mit extrem reinen Substanzen arbeiten, da schon kleinste Verunreinigungen (z. B. Wasser oder Alkanol) ein Proton freisetzen können, das mit dem Carbanion reagiert und so zum Kettenabbruch führt. Ein Abbruch der Reaktion findet erst statt, wenn Protonenlieferanten wie z. B. Wasser zugegeben werden. In Abwesenheit solcher Stoffe können die reinen, reaktiven Carbanionen, die auch „Lebende Polymere“ genannt werden, über lange Zeit hinweg aufgehoben werden. Sie dienen zur Synthese von Block-Copolymeren. Hierbei synthetisiert man zunächst aus einer Sorte von Monomeren ein Stück der Polymerkette, dann baut man aus einer anderen Sorte von Monomeren das nächste Stück an usw. Man erhält also Polymere, deren Ketten aus einzelnen Abschnitten bestehen, die aus verschiedenen Monomeren synthetisiert wurden. Ein Beispiel für solche Copolymere sind die Styrol-Butadien-Kautschuke, aus denen Autoreifen und Schuhsohlen hergestellt werden.
![]()
Suche nach passenden Schlagwörtern
- Abbruchreaktion
- Kunststoffe
- Kettenübertragungsreaktionen
- Polypropylen
- Radikale
- Polyethylen
- Polypropen
- PVC
- Kettenreaktion
- Inhibitoren
- radikalische Polymerisation
- Polyethen
- Kettenwachstumsreaktion
- Regler
- Initiatoren
- Rekombination
- Disproportionierung
- Kettenverzweigung
- Kettenstart
- Kettenlänge
- Polystyrol
- kationische Polymerisation
- Polyvinylchlorid
- anionische Polymerisation
- Polyacrylnitril

