Säure-Base-Theorie nach Lewis
Eine Verbindung, die nach BRÖNSTED eine Base ist, ist auch im LEWIS-Konzept eine Base. Bei den Säuren umfasst die LEWIS-Definition jedoch eine wesentlich größere Klasse von Substanzen. Eine LEWIS-Säure muss ein unbesetztes Orbital haben, das mit dem Elektronenpaar der Base besetzt werden kann.
LEWIS-Säuren sind in der Lage, Elektronenpaare aufzunehmen, sie sind Elektronenpaar-Akzeptoren. LEWIS-Basen sind in der Lage, Elektronenpaare zur Verfügung zu stellen, sie wirken als Elektronenpaar-Donatoren.
Nach der 1923 von GILBERT NEWTON LEWIS aufgestellten Säure-Base-Theorie wird das Proton selbst als Säure betrachtet.
Nach der BRÖNSTED-Theorie ist saures oder basisches Verhalten eine Folge der Fähigkeit eines Moleküls oder Ions, ein Proton abzuspalten oder aufzunehmen. Das Proton ist damit als Teilchen zur Übertragung von sauren oder basischen Eigenschaften anzusehen. Da eine BRÖNSTED-Base immer nur dann ein Proton aufzunehmen vermag, wenn es über ein freies Elektronenpaar verfügt, ist der Begriff der Base durch BRÖNSTED allgemeiner gefasst als der Begriff der Säure, die ja an das Proton gebunden ist und somit in gewisser Weise eine Überbetonung der Rolle des Protons zum Ausdruck bringt. Eine Base jedoch, die ihr Elektronenpaar mit einem Proton teilen kann, kann dieses Elektronenpaar ebenso gut mit anderen, als Elektronenpaarakzeptoren wirkenden Spezies teilen. Diese Verallgemeinerung führt zur Säure-Base-Definition nach LEWIS :
Säuren sind in der Lage, Elektronenpaare aufzunehmen, sie sind Elektronenpaar-Akzeptoren. Basen sind in der Lage, Elektronenpaare zur Verfügung zu stellen, sie wirken als Elektronenpaar-Donatoren.
Eine Lewis-Base verfügt also über ein freies Elektronenpaar während die Lewis-Säure über eine leeres Atom- oder Molekül-Orbital verfügt. Damit ist die Voraussetzung zur Ausbildung einer kovalenten Bindung infolge einer solchen LEWIS-Säure-Base-Wechselwirkung gegeben.
Wenn die LEWIS-Säure mit A und die Lewis Base mit :B symbolisiert wird, entspricht die grundlegende Reaktion der Bildung eines Komplexes A-B:
Eine Verbindung, die nach BRÖNSTED eine Base ist, ist auch im LEWIS-Konzept eine Base. Bei den Säuren umfasst die LEWIS-Definition jedoch eine wesentlich größere Klasse von Substanzen. Eine LEWIS-Säure muss ein unbesetztes Orbital haben, das mit dem Elektronenpaar der Base besetzt werden kann.
Aber auch die Reaktion eines Protons mit Basen wie ist lediglich ein Spezialfall einer LEWIS-Säure-Base-Reaktion.
![]()
Die LEWIS-Theorie ist zwar umfassender, aber schwerer handhabbar als die BRÖNSTED-Theorie. Ausserdem ist die Stärke der Säuren und Basen - anders als nach der BRÖNSTED-Theorie - viel schwieriger quantifizierbar. In der organischen Chemie leistet dieses Konzept aber wertvolle Dienste bei der Beschreibung von Reaktionsabläufen.
Beispiele für Lewis-Säuren
1. Moleküle oder Atome mit unvollständigem Elektronenoktett wie oder das Schwefel-Atom sind typische LEWIS-Säuren.
Mit Halogenid-Ionen bilden diese Verbindungen viele Halogeno-Komplexe:
![]()
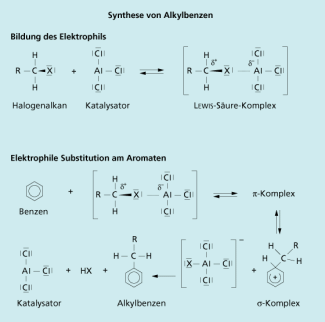
Diese Reaktion hat für FRIEDEL-CRAFTS-Alkylierungen in der organischen Synthese große Bedeutung. Die FRIEDEL-CRAFTS-Reaktionen beinhalten die Umsetzung von Aromaten mit Halogenalkanen und mit Carbonsäurehalogeniden (Carbonsäurederivate) in Gegenwart von Aluminiumtrichlorid oder Aluminiumtribromid als Katalysator.
Bei der Reaktion von Benzenen mit Carbonsäurechloriden - die Synthese von Ketonen - handelt sich um eine elektrophile Substitution am Aromaten . Das Elektrophil ist ein Komplex aus dem Halogenalkan und dem Aluminiumtrichlorid als LEWIS-Säure. Dadurch wird das Kohlenstoffatom, dass mit dem Chloratom verbunden ist, noch stärker partiell positiviert, so dass es in der Reaktion als Elektrophil reagiert. Die Bildung eines echten Carbo-Kations ist nur bei tertiären Halogenalkanen wie dem tertiären Butylbromid (2-Methyl-2-brompropan) zu diskutieren. Auf den Aromaten wird bei dieser Reaktion also eine Alkyl-Gruppe übertragen. Neben der technisch durchgeführten Reaktion von Benzen mit Alkenen unter stark sauren Bedingungen ist die FRIEDEL-CRAFTS-Alkylierung die Hauptreaktion zur Synthese der Alkylbenzene (Bild 2).
Auch die Bildung von Thiosulfat, S durch Kochen von Sulfitlösung, mit Schwefel gehorcht dem LEWIS-Säure-Base-Reaktionsprinzip.
![]()
2. Viele einfache Kationen sind als LEWIS-Säuren aufzufassen:
3. Die Atome vieler Übergangsmetalle können als LEWIS-Säuren agieren, weil sie über leere d-Orbitale verfügen.
-
Die FRIEDEL-CRAFTS-Alkylierung ist eine LEWIS-sauer katalysierte Reaktion.
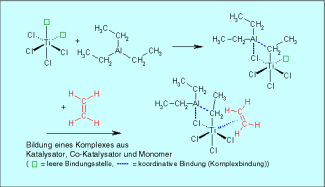
So werden ZIEGLER-NATTA-Katalysatoren, die aus Verbindungen von Übergangsmetallen bestehen, zur Polymerisation von Polyethylen genutzt. An eine freie Koordinationstelle am Titan (LEWIS-Säure) lagert sich ein Ethenmolekül (LEWIS-Base) an.
Ein typischer ZIEGLER-NATTA-Katalysator besteht aus Titantetrachlorid und Triethylaluminium als Cokatalysator (Bild 3).
4. Verbindungen von Elementen, deren Valenzschale über das Elektronenoktett hinaus aufgeweitet werden kann, können als LEWIS-Säuren reagieren. Reaktionen von mit Halogenidionen sind derartige Beispiele.
5. Nicht zuletzt kann auch an bestimmten Atomen, die in Molekülen an elektronegative Elemente wie Sauerstoff gebunden sind, die Elektronendichte soweit erniedrigt sein, dass sie als LEWIS- saures Zentrum agieren können. Die Bildung von Carbonat-Ionen durch Einleiten von in alkalische Lösungen ist dafür ein Beispiel. Analog bildet festes bei erhöhten Temperaturen mit Metalloxiden eine Vielzahl von Silicaten, die das Anion enthalten.
-
ZIEGLER-NATTA-Katalysatoren stellen im weitesten Sinne ebenfalls LEWIS-Säuren dar.