August Kekule
* 07.09.1829 in Darmstadt
† 13.07.1896 in Bonn
FRIEDRICH AUGUST KEKULE VON STRADONITZ wurde als KEKULE bekannt. Er erforschte die Bindungen des Elements Kohlenstoff, entwickelte die Theorie der Vierwertigkeit des Kohlenstoffes und ergänzte diese mit seiner Theorie von der Kettenform der Kohlenstoff-Kohlenstoff-Bindung. Berühmt wurde KEKULE durch die Hypothesen zur Struktur des Benzols (heute Benzen). In diesem Zusammenhang entwickelte er die Oszillationshypothese.
Die Zeit in der er lebte
FRIEDRICH AUGUST KEKULE VON STRADONITZ lebte im 19. Jahrhundert, einer Zeit großer politischer Veränderungen. Die Französische Revolution Ende des 18. Jahrhunderts hatte ein erfolgreiches Ende genommen und beeinflusste auch die Entwicklung anderer europäischer Länder.
Die industrielle Revolution, die schon in der 2. Hälfte des 18. Jahrhunderts in England begonnen hatte, wurde nun auch in Deutschland spürbar. Die industrielle Produktionsweise setzte sich schrittweise durch, Fabriken und neue Maschinen entstanden. Im Bergbau und Hüttenwesen entwickelten sich neue Methoden.
1825 entsteht das erste deutsche Gaswerk. Ab 1810 fuhren Dampfschiffe und die Eisenbahn entwickelte sich zum allgegenwärtigen Transportmittel.
Kokshochöfen entstehen und der Maschinenbau entwickelt sich. Das 1856 entwickelte BESSEMER-Verfahren zur Eisen- und Stahlherstellung wird 1861 eingeführt, 1869 und1878 folgen das Siemens-Martin-Verfahren und das Thomas-Verfahren.
Lebenslauf
FRIEDRICH AUGUST KEKULE VON STRADONITZ, bekannt geworden als KEKULE, wurde am 7. September 1829 in Darmstadt geboren. Er war der Sohn eines Oberkriegsrates.
1847 begann KEKULE zunächst ein Studium der Architektur an der Universität in Gießen, wo er auch Vorlesungen des Chemikers LIEBIG besuchte. Diese beeinflussten ihn so sehr, dass er sich schließlich der Chemie zuwandte.
1851/52 unternahm KEKULE eine Studienreise nach Paris, wo er mit Gerhard und Dumas Bekanntschaft machte. Deren Lehren übten einen starken Einfluss auf ihn aus, nach seiner Rückkehr nach Gießen.
Im Jahr 1852 promovierte er hier und nahm eine Assistentenstelle auf Schloss Reichenau (bei Chur) an.
1854 begab er sich als Assistent von Stenhouse nach London, wo er die Wissenschaftlern William Odling (1829), Alexander Williamson (1824-1904) und Edward Frankland (1825-1899) kennenlernte.
KEKULES weitere wissenschaftliche Entwicklung wurde von ihren Theorien nachhaltig beinflusst. Noch im gleichen Jahr legte KEKULE am Royal Society eine Arbeit vor, die bereits erste Ansätze seiner späteren Valenzlehre enthielt. Im Anschluss daran begab er sich nach Heidelberg und arbeitete dort als Privatdozent.
KEKULE befasste sich auch mit dem sogenannten „Knallquecksilber“, einer Verbindung, die sich als Salz der Knallsäure (Fulminsäure; HCNO) mit dem Metall Quecksilber bildet. In seiner Veröffentlichung: „Über die Konstitution des Knallquecksilbers“ schreibt er über den explosiven Charakter dieser Verbindung.
Ab 1857 war KEKULE als ordentlicher Professor an der Universität in Gent tätig. 1858 erschien sein Werk „Über die Konstitution und die Metamorphosen der chemischen Verbindungen und über die chemische Natur des Kohlenstoffs“.
Hier beschreibt KEKULE als Erster die Vierwertigkeit des Kohlenstoffatoms aufgrund seines Atombaus. Damit konnte er auch die Kettenform von Kohlenstoff-Kohlenstoff-Bindungen vorhersagen. Dabei wies er insbesondere auf die tetraedrische Anordnung der vier „Valenzen“ des Kohlenstoffs hin.
Aus diesen ersten Vorstellungen KEKULES entwickelte einige Jahre später sein Schüler VAN'T HOFF das Tetraedermodell.
1859 begann er mit der Arbeit an seinem „Lehrbuch der organischen Chemie“.
1865 schuf KEKULE seine „Benzoltheorie“ (Benzentheorie), in der er die Struktur von Benzol (Benzen) erklärt. Danach besteht Benzen aus einem symmetrischen Ring von 6 Kohlenstoffatomen, mit insgesamt 6 Wasserstoffatomen. Die Kohlenstoffatome sind laut KEKULE abwechselnd mit Einfach- und Doppelbindungen verknüpft.
Seine Benzoltheorie veröffentlichte KEKULE in dem Beitrag „Sur la Constitution des Substances Aromatiques“ 1865, der vor der Französischen Akademie der Wissenschaften verlesen wurde. In ausführlicher Form erschien sie ein Jahr später in LIEBIGs Annalen.
1867 wechselte KEKULE als ordentlicher Professor nach Bonn.
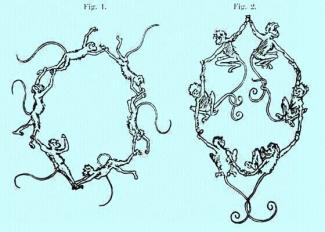
Im gleichen Jahr veröffentlichte er sein Buch „Chemie der Benzolderivate“. Später erzählte er, die Idee zu dieser Struktur sei ihm im Traum gekommen. Die Reihen der Atome glichen, nach seinen Worten, Affen (oder Schlangen), die sich im Kreis drehten, um sich schließlich an den Händen zu fassen und einen Ring zu bilden.
KEKULES Benzoltheorie hatte eine ungeheuer anregende Wirkung in der Wissenschaft und führte zu heftigen Diskussionen in der Fachwelt.
Einerseits erhielt sie viel Zustimmung, da sie eine Lösung der bis dahin unbekannten Struktur von Aromaten anbot. Andererseits gab es aber auch reichlich Widerspruch.
Denn Benzol (Benzen) verhielt sich in chemischen Reaktionen nicht wie ein Stoff mit Doppelbindungen, die es ja nach KEKULE besitzen sollte. Ein Stoff mit mindestens einer Doppelbindung entfärbt Brom durch Additionsreaktion. Benzol (Benzen) jedoch reagierte nicht mit Brom. Die Struktur konnte also nicht so wie ursprünglich beschrieben sein.
KEKULE befasste sich weiter mit diesem Problem und entwickelte 1872 die Oszillationssynthese. Diese beruhte auf der Annahme, dass die Einfach- und Doppelbindungen ständig zwischen den Kohlenstoffatomen ihre Plätze wechseln. KEKULE nannte dies „alternierende Bindungen“.
Erst später fand man das Elektronensextett im Innern des Benzenrings (und aller Aromaten) als Begründung für die besonderen Eigenschaften des Benzens und der Aromaten
FRIEDRICH AUGUST KEKULE VON STRADONITZ starb im Alter von 67 Jahren am 13. Juli 1896 in Bonn.
Bedeutende Leistungen
- Theorie von der Vierwertigkeit des Kohlenstoffs
- erste Vorstellungen über die tetraedrische Anordnung der Atome aufgrund der vier Valenzen des Kohlenstoffs
- „Benzoltheorie“ über die Struktur des Benzol- (Benzen-) moleküls
Anekdote
Anlässlich der 25-Jahr Feier zur Entdeckung der Benzolformel erzählte KEKULE, wie er „im Traum“ die Formel fand:
„ Ich drehte den Stuhl nach dem Kamin und versank in einen Halbschlaf. Wieder gaukelten die Atome vor meinen Augen. Kleinere Gruppen bildeten sich diesmal bescheiden im Hintergrund. Mein geistiges Auge, durch wiederholte Gesichte ähnlicher Art geschärft, unterschied jetzt größere Gebilde von mannigfacher Gestaltung.
Lange Reihen, vielfach dichter zusammengefügt; alles in Bewegung, schlangenartig sich windend und drehend.
Und siehe was war das? Eine der Schlangen erfasste den eigenen Schwanz und höhnisch wirbelte das Gebilde vor meinen Augen.
Wie durch einen Blitzstrahl erwachte ich; auch diesmal verbrachte ich den Rest der Nacht um die Consequenzen der Hypothese auszuarbeiten.“
-
Darstellung der von Kekule gefundenen Benzolstruktur nach seinem Traum.