Chemisch-technische Prozesse
Bei der industriellen Herstellung chemischer Produkte spielen wirtschaftliche und ökologische Aspekte eine weitaus größere Rolle als bei Synthesen im Labor.
Deshalb müssen großtechnische Verfahren einen möglichst vollständigen Stoffumsatz bei minimalem Energieverbrauch realisieren. Die Industrie hat zur Lösung der sich daraus ergebenden Probleme spezielle technische Syntheseprinzipien und Anlagen entwickelt, die weit über den Umfang eines einfachen Synthesereaktors hinausgehen.
Die Gewinnung chemischer Produkte im technischen Maßstab muss sich notwendigerweise von Laborsynthesen unterscheiden, weil Unternehmen wirtschaftlich arbeiten müssen und das Kosten-Nutzen-Verhältnis oberste Priorität hat. Hinzu kommt, dass industriell viel größere Stoff- und Energiemengen umgesetzt werden als im Labor, was die Kosten für Rohstoffe, Energie, Transport und Entsorgung zu einem wichtigen Faktor macht. Auch die Zeit, die zum Heizen bzw. Kühlen benötigt wird, nimmt mit zunehmender Stoffmenge zu. Sie steigt allerdings nicht proportional zur Stoffmenge, sondern ergibt sich aus dem Verhältnis von Oberfläche zu Volumen. Je größer das Volumen ist, desto kleiner ist die Oberfläche im Verhältnis dazu und desto länger dauert es, bis die gewünschte Temperatur erreicht ist.
Aus den großen Stoff- und Energiemengen, die umgesetzt werden, ergeben sich also besondere Anforderungen, speziell auch an die ökologische Verträglichkeit der Verfahren.
Sowohl aus ökonomischer als auch aus ökologischer Sicht ist ein niedriger Energieverbrauch erstrebenswert, denn einerseits ist Energie teuer, andererseits entstehen bei der Energieerzeugung Treibhausgase, die der Umwelt schaden.
Um die Umweltbelastung darüber hinaus so minimal wie möglich zu halten, werden moderne großtechnische Verfahren als geschlossene Stoffkreisläufe konzipiert. Weiterhin achtet man darauf, dass keine Nebenprodukte, insbesondere Umweltschadstoffe, entstehen, die aufwändig entsorgt werden müssen. Falls Schadstoffe entstehen, muss darauf geachtet werden, dass sie nicht in die Umwelt gelangen, was z. B. durch eine Abgasreinigung erreicht wird.
Alle diese Dinge führen dazu, dass im Vergleich zur Synthese im Labor die vielen erforderlichen „nicht-chemischen“ Operationen wie z. B. Pumpen für den Stofftransport, Wärmetauscher, Stoff-Trennanlagen und Abgas-Reinigungsanlagen oft bewirken, dass die Summe der nötigen Anlagen einen weit größeren Umfang hat als der chemische Reaktor selbst.
Rohstoffe
Voraussetzung für die Herstellung eines Produktes ist die Verfügbarkeit geeigneter Rohstoffe. Diese sind im Labor meist andere als in der Technik. Im Labor kann man beispielsweise Chlor durch Oxidation von Chlorwasserstoff mit Kaliumpermanganat oder Braunstein (Mangandioxid) herstellen, indem man Salzsäure auf eine dieser Manganverbindungen tropft. Die technische Herstellung erfolgt durch Elektrolyse einer wässrigen Lösung von Natriumchlorid, was im Labor relativ aufwändig wäre. Da Natriumchlorid aber in der Natur als Steinsalz in großen Mengen verfügbar ist und leicht abgebaut werden kann, ist es als Rohstoff den oben erwähnten Manganverbindungen vorzuziehen.
-
Schema der großtechnischen Chloralkalielektrolyse (Membranverfahren)
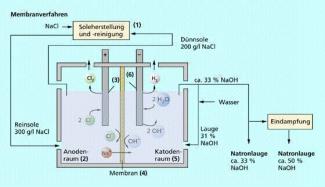
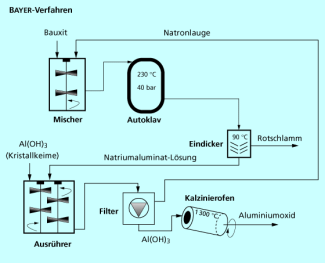
Technische Rohstoffe sind z. B. mineralische Rohstoffe wie Erze oder Salze, fossile Rohstoffe wie Erdöl oder Erdgas bzw. nachwachsende Rohstoffe wie Pflanzenöle oder Cellulose. Diese liegen fast nie in reiner Form vor, sie müssen daher meist erst durch Abtrennung störender Begleitstoffe aufbereitet werden. So müssen z. B. die Ca-, Mg- und Fe-Ionen aus dem geförderten Natriumchlorid bei der Chloralkali-Elektrolyse abgetrennt werden, oder für die Aluminiumherstellung muss Aluminiumoxid nach dem Bayer-Prozess aus Bauxit gewonnen werden.
Oft ist in der Technik nur ein einziger Rohstoff für die Herstellung eines Produktes verfügbar, z. B. Luftstickstoff zur Synthese von Ammoniak. In anderen Fällen stehen aber verschiedene Rohstoffe zur Auswahl, z. B. kann man für die Herstellung von Schwefelsäure sulfidische Erze, natürlichen Elementarschwefel oder Schwefelwasserstoff aus Erdgas nutzen. Die Auswahl des Rohstoffs hängt dann von den standortspezifischen ökonomischen Bedingungen ab.
Thermodynamische Aspekte
Oft werden die Ausgangsstoffe nicht komplett umgesetzt, das Reaktionsgleichgewicht liegt bei den herrschenden Reaktionsbedingungen nicht vollständig auf der Seite der Produkte. Ein Beispiel hierfür ist die Ammoniak-Synthese nach dem Haber-Bosch-Verfahren, bei der folgende Reaktion abläuft:
-
Beim Bayer-Prozess wird aus Bauxit Aluminiumoxid gewonnen.
Die Bildung von Ammoniak aus den Elementen ist exotherm und verläuft unter Volumenabnahme. Nach dem Prinzip des kleinsten Zwanges begünstigen daher niedrige Temperaturen und hohe Drücke die Bildung von Ammoniak. Das thermodynamische Gleichgewicht liegt nur bei Temperaturen unter 200 °C und einem Druck von weit über 10 MPa weitgehend auf der Seite des Ammoniaks. In der Technik arbeitet man daher mit einem Katalysator bei 400 bis 520 °C und Drücken von 25 bis 30 MPa. Unter diesen Bedingungen verschiebt sich das Gleichgewicht wieder auf die Seite der Ausgangsstoffe, sodass man als Ausbeute 35-40 % Ammoniak erzielen könnte.
-
Die Lage des Gleichgewichts bei der Ammoniaksynthese ist abhängig von der Temperatur und dem herrschenden Druck.
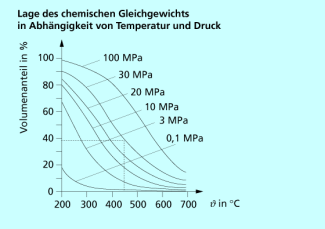
Da die Reaktionszeit im Reaktor nicht zur vollständigen Gleichgewichtseinstellung ausreicht, beträgt der tatsächlich erreichte Umsatz bei einmaligem Durchgang durch den Reaktor jedoch nur 15 bis 20 %.
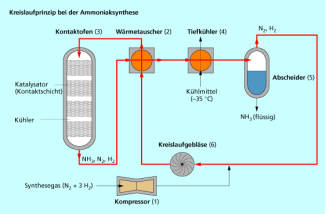
Ein vollständiger Umsatz zum gewünschten Produkt wird dann erreicht, indem die Ausgangsstoffe, die nicht reagiert haben, aus dem Gemisch abgetrennt und nach dem Kreislaufprinzip in den Prozess zurückgeführt werden, z. B. bei der Ammoniak-Synthese.
-
Die Ammoniaksynthese ist ein Beispiel für die Anwendung des Kreislaufprinzips.
Technische Katalyse
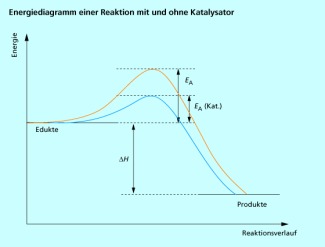
Bei vielen technischen Verfahren werden Katalysatoren eingesetzt, um die Einstellung des Gleichgewichtes zu beschleunigen, und in einigen Fällen wird durch den Katalysator die Reaktion selektiv zu einem bestimmten Zielprodukt gelenkt. Bei wichtigen technischen Prozessen wie der Ammoniak-Synthese, dem Kontakt-Verfahren für die Schwefelsäureherstellung oder dem Ostwald-Verfahren für die Salpetersäureherstellung werden Feststoff-Katalysatoren verwendet, um flüssige oder gasförmige Edukte umzusetzen, man spricht in diesem Fall von heterogener Katalyse. Bei Verwendung solcher Katalysatoren ist oft eine relativ hohe Temperatur erforderlich, weil sie erst ab einer bestimmten Temperatur, der Arbeitstemperatur, wirksam sind. Dies ist jedoch bei exothermen Reaktionen für die Lage des Gleichgewichtes nach dem Le-Chatelier-Prinzip ungünstig. So liegen z. B. bei der Ammoniaksynthese unter Verwendung des technisch üblichen Eisenkatalysator bei einer Arbeitstemperatur von 400-450 °C und einem Druck von 30 MPa nur etwa 40 % im Gleichgewicht vor. Katalysatoren aus dem seltenen Edelmetall Osmium sind aktiver und arbeiten bereits bei Temperaturen etwas unter 400 °C, wobei demzufolge höhere Ammoniakkonzentrationen im Gleichgewicht vorliegen. Praktisch arbeitet man aber mit dem Eisenkatalysator, weil er viel billiger ist.
Bei zahlreichen Verfahren ist man daher nach wie vor auf der Suche nach verbesserten Katalysatoren, die beispielsweise bei tieferen Temperaturen bereits aktiv sind oder die bei der Arbeitstemperatur ihre katalytische Aktivität länger behalten.
-
Durch Einsatz eines Katalysators wird die Aktivierungsenergie erniedrigt.
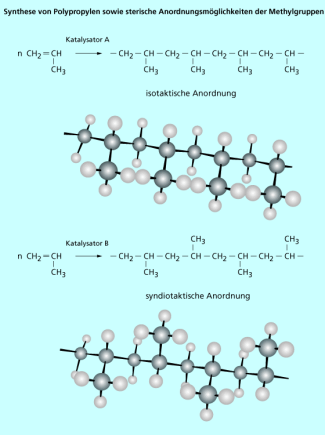
Bei der homogenen Katalyse findet die Reaktion meist in flüssiger Phase statt, und der Katalysator ist in der Flüssigkeit gelöst wie z. B. Schwefelsäure bei einer Veresterung. Hierbei ist es häufig auch möglich, durch die Wahl des Katalysators die Reaktion selektiv zu einem Zielprodukt zu lenken (vergleichbar mit der selektiven Wirkung von Enzymen in der Biochemie). So kann man beispielsweise bei der Polymerisation von Propen durch die Wahl des Katalysators die Polymerisationsreaktion so steuern, dass die Methylgruppen entweder alle zur gleichen Seite der Polymerkette zeigen oder streng wechselständig angeordnet sind. Die entsprechenden Produkte unterscheiden sich dann in ihren Eigenschaften.
-
Bei der Synthese von Polypropylen entstehen je nach verwendetem Katalysator Polymere mit unterschiedlichen Eigenschaften.
Ablauf chemisch-technischer Prozesse
Im Labor arbeitet man diskontinuierlich, d. h. die Ausgangsstoffe werden in einem Kolben zusammengegeben, bei Bedarf auf Reaktionstemperatur erwärmt, nach Ablauf der Reaktion abgekühlt und das entstandene Produkt aufgearbeitet.
Technische Prozesse laufen oft im kontinuierlichen Betrieb, d. h. Rohstoffe werden den Reaktor ständig zugeführt, Produkte ständig entnommen und aufgearbeitet. Dieses Prinzip stellt hohe Anforderungen an die Zuverlässigkeit aller Anlagen und auch an die gleichmäßige Qualität und Beschaffenheit der Rohstoffe, hat aber verschiedene Vorteile. So entfällt das aufwändige Anfahren (Anschalten, Aufheizen usw.) der Anlagen, wofür viel Energie nötig ist, weil viele chemische Prozesse erst bei höheren Temperaturen ablaufen, die Schwefelsäure-Synthese beispielsweise bei 420-450 °C. Die Ausgangsstoffe müssen daher auf Reaktionstemperatur aufgeheizt und die heißen Reaktionsprodukte dann wieder abgekühlt werden. Im Labor stellt die Bereitstellung der Energie für Heizen und Kühlen meist kein Problem dar. In der Technik ist aber die effektive Nutzung der Energie entscheidend, daher wird für beide Prozesse das Gegenstromprinzip zum Wärmetausch eingesetzt, d. h. die heißen Reaktionsprodukte werden zum Aufheizen der Ausgangsstoffe genutzt, was nur beim kontinuierlichen Betrieb gut durchführbar ist. Wenn eine direkte Kopplung dieser Art nicht möglich ist, wird die Energie der heißen Reaktionsgase zur Erzeugung von Hochdruckdampf genutzt, der einen Druck von bis zu 4 MPa und eine Temperatur von 300 °C hat.
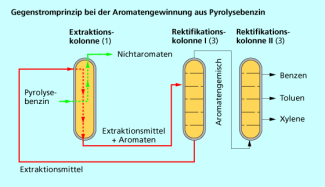
Das Gegenstromprinzip wird manchmal auch zum Stoffaustausch genutzt, z. B. beim Hochofen-Prozess oder bei der Flüssig-Flüssig-Extraktion zur Gewinnung von Aromaten aus Benzinfraktionen.
Nebenprodukte
Meist entstehen bei einer Reaktion Nebenprodukte. Beispielsweise erhält man bei der Chlorierung von Benzen neben dem Zielprodukt Monochlorbenzen auch immer etwas Dichlorbenzen, und ein Teil des Benzens ist noch nicht umgesetzt. In diesen Fällen muss eine Stofftrennung des Gemisches aus Zielprodukt, Nebenprodukten und nicht umgesetzten Rohstoffen erfolgen, um das Zielprodukt in großer Reinheit zu gewinnen, was im Labor häufig nicht erforderlich ist.
Eine besondere Art von Nebenprodukten sind die sogenannten Koppelprodukte , die bei zahlreichen technischen Prozessen entstehen, so liefert die Chloralkali - Elektrolyse Chlor, Natronlauge und Wasserstoff. Dies hat den Vorteil, dass mit einem Verfahren mehrere nutzbare Produkte hergestellt werden können. Der Nachteil ist jedoch, dass die Mengen der Koppelprodukte in einem bestimmten Verhältnis zueinander stehen. Wenn also in der Wirtschaft z. B. mehr Natronlauge benötigt wird, muss dann auch eine Verwendung für das zusätzlich mit produzierte Chlor gegeben sein.
Ökologie
Die Verwertung oder schadlose Entsorgung unerwünschter Nebenprodukte ist im Labor meist nicht wichtig oder einfach handhabbar, in der Technik ist das oft schwieriger. Die Vermeidung von schädlichen Abfällen und von Schadstoffemissionen in die Atmosphäre oder in Gewässer sind bei technischen Verfahren von entscheidender Bedeutung. So muss z. B. bei der Herstellung von Schwefelsäure oder Salpetersäure eine Abgasreinigung durchgeführt werden.
Durch Gebrauch verunreinigte Chemikalien werden im Labor in der Regel als Abfall entsorgt. So wird z. B. eine geringe Menge verdünnter Schwefelsäure entweder mit Natronlauge neutralisiert und die entstehende Natriumsulfat-Lösung dann ins Abwasser gegeben, oder es wird mit Calciumhydroxid neutralisiert, das ausfallende Calciumsulfat abfiltriert und als unschädlicher Feststoff entsorgt. Das wurde in der Vergangenheit in der chemischen Industrie zwar auch in ähnlicher Weise praktiziert, was aufgrund der großen Mengen, die zum Teil mit Schadstoffen verunreinigt sind, ökologisch äußerst bedenklich ist. Seit einiger Zeit werden daher in der Industrie zunehmend derartige „Abfälle“ recycelt, so dient z. B. verdünnte verunreinigte Schwefelsäure aus der Titandioxid-Produktion, sogenannte Dünnsäure, als Rohstoff für die Schwefelsäureherstellung.
-
Das Gegenstromprinzip wird beispielsweise bei der Aromatenextraktion angewandt.
Suche nach passenden Schlagwörtern
- homogene Katalyse
- Stofftrennung
- Rohstoffe
- heterogene Katalyse
- technische Chemie
- Prinzip des kleinsten Zwanges
- technische Katalyse
- Gegenstromprinzip
- kontinuierliche Arbeitsweise
- Kreislaufprinzip
- Großtechnik
- kontinuierlicher Betrieb
- Gleichgewicht
- Koppelprodukte
- großtechnische Anlagen
- Entsorgung
- Umwelt
- großtechnische Verfahren
- Ökologie

