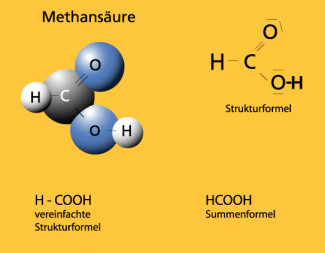
Methansäure
Die Methansäure wird aufgrund ihres Vorkommens in den Giftsekreten der Ameisen auch Ameisensäure genannt.
1670 wurde diese Säure in Waldameisen entdeckt. Ihre Summenformel lautet HCOOH. Sie zählt zur Gruppe der Carbonsäuren und stellt deren stärksten sauren Vertreter dar. Da sie auch als Aldehyd reagieren kann, nimmt sie eine Sonderstellung in der Gruppe der Carbonsäuren ein.
Ameisen und auch einige Käfer bilden Giftsekrete, die ihrer Verteidigung dienen. Sie enthalten 1,5 bis 2 mg 75%ige Methansäure. Insbesondere von Brennnesseln ist ebenfalls bekannt, dass ihre Brennhaare Methansäure enthalten. Die Spitzen dieser Brennhaare bohren sich in die Haut und brechen ab. die Säure wird freigesetzt. Sie ruft z.T. recht heftige Reaktionen auf der Haut hervor.
Nach der ersten Entdeckung in dem Sekret der Ameisen erhielt diese Säure den Trivialnamen „Ameisensäuren“, in denen sie 1670 von FISCHER festgestellt wurde. Durch Destillation wurde die Säure 1749 in ziemlich reiner Form hergestellt. Bei der Benennung der Salze dieser Säure als Formiate kommt auch zum Ausdruck, dass die Säure zuerst in der Waldameise Formica entdeckt wurde.
Eigenschaften und Struktur
Die Methansäure ist eine leicht bewegliche, flüchtige, klare, farblose, brennend schmeckende, stechend riechende Flüssigkeit.
Dichte: 1,214 (bei 25 °C, wasserfrei)
Schmelztemperatur: 8,4 °C
Siedetemperatur: 101 °C
molare Masse: 46,0 g/mol
Die Dämpfe der Methansäure wirken stark reizend auf Atemwege und Augen. Zu Verätzungen von Haut und Augen führt jeglicher Kontakt mit der Flüssigkeit (auch in verdünntem Zustand).
Sie ist in jedem Verhältnis mit Glycerin, Ethanol, Ether und Wasser mischbar. Üblicherweise sind wässerige Lösungen 25%ig. Deren Dichte beträgt ca. 1,06 .
Der fachsystematische Name ergibt sich aus ihrer Struktur. Die Summenformel der Verbindung lautet HCOOH.
Methansäure ist der einfachste Vertreter der Carbonsäuren. Da sie sich von den Alkanen ableitet und nur eine Carboxylgruppe aufweist, gehört sie innerhalb der Carbonsäuren zu den Alkansäuren.
In der Struktur wird aber im Gegensatz zu anderen Alkansäuren eine Besonderheit deutlich. Dadurch, dass sich im Molekül nur ein Kohlenstoffatom befindet, welches neben der Doppelbindung zum Sauerstoffatom und der Bindung zur Hydroxylgruppe noch eine Bindung zu einem Wasserstoffatom aufweist, kann die Methansäure auch als Aldehyd wirken (Aldehydgruppe: Doppelbindung zwischen einem Kohlenstoffatom und einem Sauerstoffatom und eine Bindung zwischen einem Kohlenstoff- und einem Wasserstoffatom).
Aufgrund dieser strukturellen Besonderheit wirkt sie reduzierend, was gleichzeitig zum Nachweis genutzt werden kann. Der Nachweis mit ammoniakalischer Silbernitrat-Lösung oder mit fehlingscher Lösung ist positiv. Bei dieser Reaktion wird Methansäure zu Kohlenstoffdioxid und Wasser zersetzt.
Abgesehen davon reagiert die Methansäure aufgrund der Carboxylgruppe wie eine Säure. Ihre Lösungen zeigen eine saure Reaktion, weil bei der Reaktion mit Wasser Wasserstoff-Ionen (bzw. Hydronium-Ionen) gebildet werden.
![]()
Ebenso sind Salzbildungsreaktionen typisch. Die Salze der Methansäuren nennt man Formiate.
![]()
Bedingt durch die Carboxylgruppe kann die Methansäure mit Alkoholen zu Estern reagieren.
Herstellung
Es gibt verschiedene Möglichkeiten der technischen Herstellung. Bei der Gewinnung von Essigsäure (durch Luftoxidation z. B. von Leichtbenzin bildet sich Methansäure als Nebenprodukt..
Technisch wird die Säure aus Kohlenstoffmonooxid und Methanol gezielt produziert. Der dabei gebildete Methansäuremethylester wird anschließend zu Methansäure umgesetzt.
Ein neueres Verfahren ist die Direkthydrolyse. Aus Natriumhydroxid und Kohlenstoffmonooxid wird bei 120 °C und einem Druck von 0,8 MPa Natriumformiat gebildet, welches anschließend mit Schwefelsäure zersetzt wird.
Verwendung
In der Medizin wird der sogenannte Ameisenspiritus, ein Gemisch aus Methansäure, Ethanol und Wasser, als Antirheumatikum eingesetzt.
In Lebensmitteln ist Ameisensäure selbst ein erlaubter Konservierungsstoff (E 236), ebenso dürfen die beiden Salze Calciumformiat (E 238) und Natriumformiat (E 237) eingesetzt werden. Die Ameisensäure wird zum Desinfizieren von Wein- und Bierfässern verwendet.
Weitere Verwendungsmöglichkeiten bestehen im Ansäuern von Silofutter.
Methansäure wird in der Kautschukindustrie als Koagulierungsmittel, außerdem zum Entkalken von Boilereinsätzen, in der Gerberei, sowie in der Leder- und Textilindustrie zum Beizen, Imprägnieren und Mattieren eingesetzt.
-
Modell und Formeln der Methansäure.