Salzlagerstätten
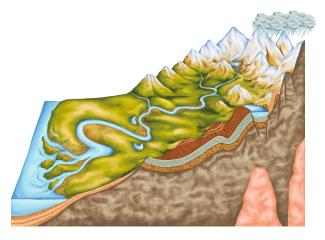
Die Salzlagerstätten wurden in der Erdgeschichte durch Eindampfen von abgetrennten Meeresteilen gebildet, so z. B. in Europa vor etwa 200 Millionen Jahren aus dem Zechsteinmeer. Die Salzlagerstätten liegen in 300-1 500 m Tiefe und sind zum Teil über 100 m dick. Entsprechend der unterschiedlichen Löslichkeit der Salze im Meer erfolgte die Ablagerung in Schichten.
Kochsalz - lebenswichtig und vielseitig verwendbar
Seit je her ist das Kochsalz ein wichtiger Bestandteil unseres alltäglichen Lebens. Es findet seine Anwendung nicht nur als Ausgangsmaterial für viele Natriumverbindungen, sondern dient auch als Konservierungsmittel, Streusalz und Geschmacksverstärker. Der menschliche Organismus ist auf die Zufuhr des wichtigen Chlorids angewiesen; denn es ist für die Funktion von Verdauung und Nervensystem von ausschlaggebender Bedeutung, eine Unterversorgung des Stoffwechsels mit Natriumchlorid, würde in der Blutflüssigkeit zu lebensgefährlichen Störungen führen. Bei hohem Blutverlust wird daher immer eine sterile - für Säugetiere 0,9%ige - Kochsalzlösung als Flüssigkeitsersatz dem Blut des Verletzten zugeführt, denn diese isotonische Lösung besitzt den gleichen osmotischen Druck wie auch das Blut.
In den Industrieländern besteht heute jedoch eher eine Gefährdung der Gesundheit durch Überversorgung mit Salz. Es steht im Verdacht in zu hoher Konzentration für Bluthochdruck verantwortlich zu sein.
Entstehung und Vorkommen von Salzlagerstätten
Für uns unvorstellbar große Mengen an Salzen befinden sich gelöst im Wasser der Ozeane und Meere. Die Ostsee besitzt mit einem Salzgehalt von 1,5% einen geringen Salzgehalt, das Tote Meer mit 22% einen sehr hohen. Der durchschnittliche Salzgehalt aller Ozeane und Meere liegt bei 3,5%.
Weitere riesige Mengen an Salzen befinden sich in unterirdischen Lagerstätten. Salzlagerstätten entstehen allerdings nur dann, wenn sich der Salzgehalt, der in Wasser gelösten Salze, drastisch erhöht. Dieser Fall tritt nur durch das Verdunsten des Wassers ein. Die verschiedenen Salze scheiden, je nach Löslichkeit und Menge, in einer bestimmten Reihenfolge (salinarer Zyklus) aus. Durch chemische Verwitterung der Gesteine, lagern sich Carbonate wie Kalk ab, als nächste Schicht die Sulfate und letztendlich Steinsalz (Natriumchlorid) und Kalium- und Magnesiumsalze. Die Salzlager auf unserem Gebiet sind durch diese Salzablagerungen vor rund 200 Millionen Jahren aus dem Zechsteinmeer hervorgegangen. Zu jener Zeit herrschten auf unserem Planeten ganz andere klimatische Verhältnisse. In Europa war es heiß und trocken (arides Klima). Die Verschiebungen des Meeresboden führten zu Wölbungen, sodass kleinere Becken entstanden, in denen das Wasser durch die hohen Außentemperaturen rasch verdunsten konnte. Die entstandene Salzschicht im ausgetrockneten Becken wurde mit Staub- und Sandschichten (Salztone) bedeckt und somit vor Witterungseinflüssen geschützt. Es bildeten sich Gesteinsschichten und die darunter liegenden Salzschichten senkten sich über viele Millionen Jahre hinweg ab.
In der Bundesrepublik Deutschland findet man solche Lagerstätten vor allem im Unstrut-Saale-Gebiet und im Werra-Fulda-Gebiet.
Gewinnung:
Auf diese Weise entstandene Salzlager liegen in ca. 300 - 1 500 m Tiefe und werden bergbaulich zur Salzgewinnung erschlossen. Die Räume, in denen das Salz abgebaut wird, können bis zu 2000 groß sein. Ein Stützen der Abbauräume ist durch die Festigkeit der Salze nicht notwendig. Mithilfe von sogenannten Schrämmmaschinen oder durch Bor- und Schießarbeit wird das Salz gewonnen.
Eine andere Methode ist das sogenannte Aussolen. Hierbei wird Wasser in die Salzschicht gepumpt und als Salzlösung (Sole) wieder gefördert. An der Oberfläche wird die Sole eingedampft (Siedesalz). Das kann in offenen Pfannen oder in Verdampfergefäßen erfolgen. Besonders früher nutzte man offene Pfannen. Aus dieser Technik erklärt sich die Bezeichnung „Kochsalz“.
Durch Salzabbau entstandene unterirdische Hohlräume dienen wegen ihrer Festigkeit als Kavernen zur Erdgasspeicherung oder als Zwischenlager für radioaktive Abfallprodukte.
-
schematischer Aufbau einer Salzlagerstätte
stihii - shutterstock

