Bestimmung von Oxidationszahlen
Oxidationszahlen sind formale Größen zur Beschreibung von Redoxreaktionen. Sie werden in römischen Ziffern über die Elementsymbole geschrieben. Die Änderung der Oxidationszahlen ist das charakteristische Merkmal von Redoxreaktionen.
Für die Bestimmung der Oxidationszahlen gibt es einfache Regeln. Bei komplexeren Verbindungen oder Teilchen ermittelt man die Oxidationszahlen der Atome anhand der Lewis-Formel, indem man formal eine heterolytische Bindungsspaltung durchführt.
Redoxreaktionen sind Reaktionen mit Elektronenübergang zwischen den Reaktionspartnern. Der Elektronenübergang ist jedoch nur bei der Ausbildung von Ionen sofort erkennbar. Bei kovalenten Verbindungen werden nur gemeinsame Elektronenpaare gebildet, die stärker vom elektronegativen Partner angezogen werden.
Um auch hier den Elektronenübergang quantitativ zu beschreiben, benutzt man das Modell der Oxidationszahlen. Dazu geht man formal davon aus, dass alle Stoffe - also auch die kovalenten Verbindungen – aus sogenannten Atom-Ionen aufgebaut sind. Man stellt die LEWIS-Formel auf und ordnet in Gedanken beide Elektronen einer polaren Atombindung dem elektronegativeren Partner zu. Diese gedankliche Vorgehensweise entspricht einer heterolytischen Bindungsspaltung.
Bindungspartner mit gleicher Elektronegativität teilen sich die Bindungselektronen entsprechend einer homolytischen Bildungsspaltung. An den Bindungen nicht beteiligte Elektronenpaare (freie Elektronenpaare) verbleiben beim dazugehörigen Atom (Bild 1).
Es ist hervorzuheben, dass es sich bei der gedanklichen Bindungsspaltung nur um einen Formalismus handelt, die Bindungen werden in der Realität nicht gespalten. Aus der Anzahl der Elektronen der formal gebildeten Atom-Ionen kann man jedoch jetzt die Oxidationszahlen bestimmen.
Dazu vergleicht man die Zahl der Valenzelektronen des neutralen Atoms im PSE mit der Zahl der Elektronen, die ihm gedanklich anhand der LEWIS-Formel zugeteilt worden sind.
Die Oxidationszahl (OZ) eines Atoms in einer Verbindung ist die Differenz aus der Valenzelektronenzahl (VEZ) des neutralen Atoms und der Anzahl der Elektronen des formal gebildeten Atom-Ions (EZA). Die OZ werden in römischen Zahlen über die Elementsymbole geschrieben. Negative OZ erhalten ein negatives Vorzeichen. Sie entsprechen jedoch keinen realen Ladungen. Die Änderung der OZ um eine Einheit entspricht der Aufnahme bzw. Abgabe eines Elektrons.
Bestimmung von OZ durch formale Bindungsspaltung
Im Kohlenstoffdioxid ist Kohlenstoff der elektropositivere Partner gegenüber Sauerstoff. Somit werden dem Sauerstoff alle Bindungselektronen der Doppelbindung zugeordnet, woraus sich für die Sauerstoffatome formal eine zweifach negative Ladung und die Oxidationszahl von -II ergibt. Kohlenstoff wird zum formalen mit der Oxidationszahl IV.
![]()
Im Ethin werden die Bindungselektronen der C-H-Bindung dem elektronegativeren Kohlenstoff zugeordnet. Die sechs Elektronen der C-C-Dreifachbindung werden auf beide Kohlenstoffatome gleichmäßig verteilt. Damit ergibt sich für Kohlenstoff die Oxidationszahl -I und für Wasserstoff die Oxidationszahl I.
![]()
In einer Verbindung können Atome des gleichen Elements unterschiedliche Oxidationszahlen haben, z. B. die Kohlenstoffatome im Ethanal . Das Kohlenstoffatom, an das Sauerstoff gebunden ist, besitzt mit +I eine höhere Oxidationszahl als das Kohlenstoffatom der Methyl-Gruppe (OZ -III).
![]()
Die Oxidationzahlen können Werte von +VIII bis -VIII annehmen. Eine Erhöhung der Oxidationszahl zeigt, dass eine Verbindung Elektronen abgegeben hat und so oxidiert worden ist. Die Verringerung einer Oxidationszahl entspricht einer Reduktion durch die Aufnahme von Elektronen. Mithilfe des Modells der Oxidationszahlen kann man daher entscheiden, ob es sich bei einer bestimmten Reaktion um eine Redoxreaktion handelt. Außerdem sind die Oxidationszahlen wertvolle Hilfen beim Aufstellen von Redoxgleichungen.
-
Gedanklich durchgeführte Bindungsspaltungen zur Ermittlung der Oxidationszahlen.
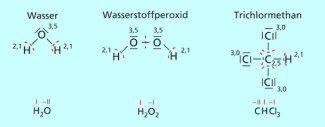
Es ist jedoch nicht immer notwendig, die LEWIS-Formeln der Verbindungen aufzustellen, um die Oxidationszahlen zu ermitteln. In den meisten Fällen genügt die Anwendung folgender Regeln zur Bestimmung von Oxidationszahlen.
| 1. | Elementsubstanzen haben immer die OZ 0 | |
| 2. | Fluor in Verbindungen hat immer die OZ -I | |
| 3. | Wasserstoff in Verbindungen hat die OZ I | |
| 4. | Sauerstoff in Verbindungen hat die OZ -II | |
| 5. | Bei Atom-Ionen entspricht die Ladung des Ions der OZ | |
| 6. | Die Summe aller OZ der Atome eines Teilchens entspricht der Ladung des betrachteten Teilchens. Bei neutralen Molekülen ist die Summe der OZ immer Null, bei Molekül-Ionen entspricht sie der Ionenladung (Bild 2). | |
Diese vereinfachten Regeln gelten im Fall von Wasserstoff (Regel 3) und Sauerstoff (Regel 4) nicht immer. Sie sind jedoch auf fast alle einfachen Verbindungen anwendbar. Die anderen Regeln gelten dagegen streng.
Ausnahmen
Wasserstoff
In Verbindung mit sehr unedlen Metallen ist Wasserstoff der elektronegativere Bindungspartner, die Bindungselektronen werden also dem Wasserstoff zugeordnet. Es erhält die OZ -I und wird als Hydrid-Ion bezeichnet . Beispiele sind:
(Natriumhydrid),
(Lithiumhydrid) oder
(Lithiumtetrahydridoaluminat)
Sauerstoff:
Gegenüber Fluor ist Sauerstoff elektropositiver. In den Verbindungen, die nur aus Sauerstoff und Fluor bestehen, weist der Sauerstoff daher eine positive Oxidationszahl auf. Die Verbindungen, werden Sauerstofffluoride genannt:
und
Verbindungen, die eine O-O-Bindung enthalten, bezeichnet man als Peroxide. Die OZ des so gebundenen Sauerstoffs ist nur -I, da infolge der O-O-Bindung bei der gedanklichen Bindungsspaltung an jedem Sauerstoffatom eines der Bindungselektronen verbleibt.
Beispiele: oder auch organische Peroxide.
Superoxide vom Typ enthalten große Kationen
() und das . Da die Kationen eine OZ von I aufweisen, muss im Anion jedes Sauerstoffatom die OZ -1/2 haben!
Sonstige ![]()
-
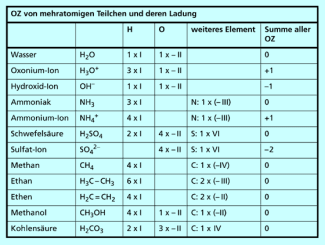
Beispiele für Oxidationszahlen mehratomiger Teilchen und Verbindungen