Isotope
Atomkerne eines Elements mit gleicher Protonenzahl, aber unterschiedlicher Anzahl von Neutronen werden als Isotope bezeichnet. Es sind spezielle Nuklide. Wegen der gleichen Protonenzahl (= Kernladungszahl) haben Isotope auch die gleiche Anzahl von Elektronen in der Hülle.
Beispiele für Isotope
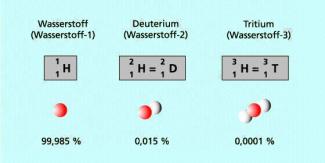
So existieren z. B. beim Wasserstoff drei in der Natur vorkommende Isotope, die als Wasserstoff, Deuterium und Tritium bezeichnet werden (Bild 1). Es gibt nur etwa 20 Elemente, die nur aus einem einzigen stabilen Isotop bestehen. Dazu gehören beispielsweise:
Die meisten Elemente bestehen aus einem Isotopengemisch, wobei die Anteile der einzelnen Isotope sehr unterschiedlich sein können.
Chlor besitzt zwei Isotope, Chlor-35 mit 75,5 % Anteil und Chlor-37 mit 24,5 % Anteil. Kupfer hat ebenfalls zwei stabile Isotope, Kupfer-63 (69,1 %) und Kupfer-65 (30,9 %).
Die meisten stabilen Isotope hat Zinn (10). Die meisten Isotope einschließlich der radioaktiven sind allerdings beim Xenon bekannt (mindestens 24).
Außer in der Neutronenzahl und damit in ihrer Masse unterscheiden sich die Isotope eines Elements und deren Verbindungen bei den leichten Elementen gering in den physikalischen Eigenschaften und im chemischen Verhalten.
So enthält der Sauerstoff 99,76 % des Isotops und 0,2 % des Isotops . Wasser der Zusammensetzung siedet bei 100,0 °C, aber Wasser mit dem schwereren Sauerstoffisotop erst bei 101,5 °C.
Analytisch kann man Isotope mithilfe eines Massenspektrometers trennen. Im technischen Maßstab ist eine Trennung gasförmiger Verbindungen eines Elements mit Zentrifugen möglich.
Dieses Prinzip wird auch bei der Herstellung von Uran-Kernbrennstoff genutzt.
In der Natur vorkommendes Uran hat drei Isotope, Uran-238 (99,28 %), Uran-235 (0,72 %) und Uran-234 (0,006 %). Für die Kernspaltung ist aber nur Uran-235 geeignet und der natürliche Gehalt reicht für die Aufrechterhaltung der Kernspaltung nicht aus. In den Brennelementen der Kernkraftwerke ist daher der Anteil an Uran-235 auf etwa 3 % angereichert.
Stabile und radioaktive Isotope
Man kann zwischen stabilen Isotopen und radioaktiven Isotopen, auch Radioisotope oder Radionuklide genannt, unterscheiden. Radioaktive Isotope zerfallen unter Aussendung radioaktiver Strahlung. Bekannt sind heute etwa 300 stabile und über 2 400 radioaktive und damit instabile Isotope.
Alle chemischen Elemente oberhalb der Ordnungszahl Z = 83 sind von Natur aus radioaktiv (natürliche Radioaktivität). Der Zerfall von z. B. dem Uranisotop ist der Beginn einer Zerfallsreihe, die mit dem stabilen Bleiisotop endet.
![]()
Künstlich radioaktive Isotope eines Elements entstehen z. B. beim Beschuss von stabilen Isotopen des Elements mit Neutronen.
Infolge eines zu ungünstigen Protonen-Neutronen-Verhältnisses ist dieser Kern nicht stabil; durch Emission von -Strahlung entsteht daraus ein stabiles Schwefelisotop.
Die stabilen und radioaktiven Isotope dienen, v. a. in der chemischen, medizinischen und biologischen Forschung, als Isotopenindikatoren (beziehungsweise Leitisotope) zur Herstellung markierter Verbindungen, die zur Verfolgung von Reaktionsabläufen und zur Aufklärung komplizierter Stoffstrukturen eingesetzt werden.
-
Isotope des Wasserstoffs und ihre Anteile