Anwendungen Redoxreaktionen
In allen Bereichen unseres Lebens begegnen wir Redoxreaktionen. Das fängt in den Organismen an, in denen Redoxreaktionen die Grundlage des Lebens darstellen, so handelt es sich beispielsweise bei der Atmung und der Fotosynthese um Redoxprozesse.
In der Industrie beruht die Herstellung vieler Produkte wie Schwefelsäure, Ammoniak und Salpetersäure oder verschiedenster organischer Stoffe auf Redoxreaktionen.
Zur Energiegewinnung werden fossile Energieträger verbrannt, d. h. sie werden oxidiert, wobei Luftsauerstoff reduziert wird.
Wichtige Reaktionen zur Gewinnung von Metallen, in der Lebensmittelindustrie oder in der chemischen Analytik sind ebenfalls Redoxreaktionen.
Redoxreaktionen sind unser Leben. Wie könnten Tiere ohne Atmung ihre benötigte Energie gewinnen? Wie könnten Pflanzen ohne Assimilation Kohlenhydrate aufbauen? Die Entstehung unserer Atmosphäre mit ihren Sauerstoffgehalt von ca. 21 % ist auf biochemische Redoxprozesse während der Fotosynthese zurückzuführen.
Redoxreaktionen in der Industrie
Redoxreaktionen sind ein sehr wichtiger Reaktionstyp in der chemischen Industrie. So wird die Schwefelsäure über die Oxidation von Schwefel oder Sulfiden zu Schwefeldioxid und anschließender katalytischen Oxidation des zu Schwefeltrioxid produziert.
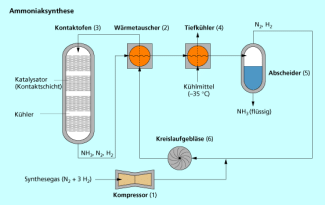
Nahezu alle stickstoffhaltigen Verbindungen (Düngemittel, Farbstoffe, Sprengmittel, Polyamide) werden aus Ammoniak erzeugt. Dieser wird durch die katalytische Reduktion von Stickstoff durch Wasserstoff - die Ammoniaksynthese - hergestellt.
Auch die Synthesen organischer Stoffe (z. B. Alkohole, Aldehyde, Ketone, Carbonsäuren oder PVC) und die technisch bedeutsamen Elektrolyseverfahren (z. B. die Chloralkali-Elektrolyse) basieren auf Redoxreaktionen.
-
Bei der Ammoniaksynthese wird Luftstickstoff durch Wasserstoff reduziert.
Redoxreaktionen zur Energieerzeugung
Über die Verbrennung von fossilen Energieträgern wie Kohle, Erdöl oder Erdgas werden in Wärmekraftwerken Elektroenergie und andere Energieträger erzeugt.
Das Verbrennen von Benzin, Diesel, Kerosin wird zum Betreiben von z. B. Kraftfahrzeugen, Flugzeugen, Schiffen genutzt.
Die Energie zum Antrieb von Raketen wird über Redoxreaktionen gewonnen. Allen festen oder flüssigen Raketentreibstoffe n liegt ein gemeinsames Prinzip zugrunde: Im Ergebnis stark exothermer Redoxprozesse werden sehr heiße, gasförmige Reaktionsprodukte gebildet. Diese besitzen eine sehr hohe kinetische Energie und treiben den Flugkörper über das Rückstoßprinzip an. Ein geeigneter Raketentreibstoff ist flüssiges Hydrazin , das mit flüssigem Sauerstoff unter Energiefreisetzung zu den gasförmigem Produkten Stickstoff und Wasser reagiert.
Explosivstoffe setzen schlagartig in exothermen Redoxreaktionen Gase frei, die sich aufgrund der hohen Temperaturen extrem ausdehnen und damit die Sprengkraft bewirken.
Redoxreaktionen in der Metallurgie
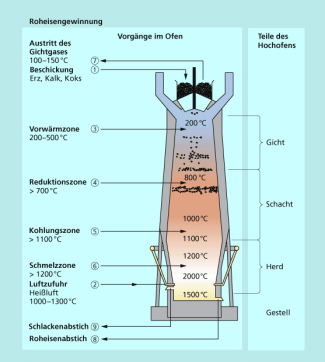
Die Metallurgie erfordert Redoxreaktionen, da die Metalle nur in Ausnahmen elementar (gediegen) in der Natur vorkommen. Sie müssen aus sulfidischen oder oxidischen Metallerzen durch Röst- und Reduktionsprozesse gewonnen werden.
Gold wird heute noch vielfach über die Cyanidlaugerei gewonnen. Im ersten Schritt wird goldhaltiger Sand in einer Cyanidlösung aufgeschlämmt und Luft hindurchgeblasen.
Das auf diese Weise gelöste Gold kann jetzt einfach vom Sand abgetrennt und mit Zink wieder ausgefällt werden.
Die Cyanidlaugerei stellt ein nicht zu unterschätzendes Umweltrisiko dar. Im Fall einer Havarie gelangt die hochgiftige Cyanidlösung in Gewässer, was zum Absterben von Fischen und anderen Lebewesen führt.
Redoxreaktionen in der Lebensmittelindustrie
Hier sei als eine wichtige Redoxreaktion die katalytische Hydrierung von Ölen zur Produktion von Margarine erwähnt. Viele Konserven enthalten Konservierungsstoffe , darunter Antioxidantien, die unerwünschte Reaktionen des Luftsauerstoffs mit den Lebensmitteln verhindern sollen. Als Antioxidantien dienen Salze wie Nitritpökelsalze oder organische Carbonsäuren, z. B. Ascorbinsäure.
-
Im Hochofen wird Koks (Kohlenstoff) oxidiert und Eisenoxid reduziert.
Redoxreaktionen in der pyrotechnischen Industrie
Bei vielen Redoxreaktionen wird ein Teil der freigesetzten Energie in Form von Licht emittiert. Das macht man sich zur festlichen Beleuchtung oder bei spektakulären Feuerwerken zunutze. Zur Beleuchtung wurden jahrhundertelang brennende Fackeln oder Kerzen benutzt. Auch in der Pyrotechnik bedient man sich der Redoxreaktionen. So enthalten Wunderkerze, Blitzlicht, Feuerwerk etc. immer Reduktionsmittel und Oxidationsmittel neben anderen Stoffen, die die Farben hervorrufen.
Redoxreaktionen in der Analytik
Viele chemische Analysenmethoden basieren auf Redoxprozessen. Dazu zählen klassische Nachweisreaktionen organischer und anorganischer Stoffe ebenso wie moderne elektrochemische Analysenmethoden und die quantitative Redoxtitration .

