chemisches Gleichgewicht
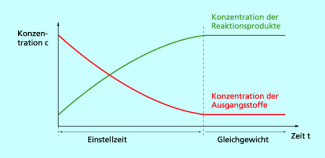
Das konstante Konzentrationsverhältnis der Edukte und Produkte charakterisiert die Lage des Gleichgewichts. Es ist unabhängig davon, ob im Kolben zu Beginn nur Ethansäure und Ethanol oder nur Ethansäureethylester und Wasser vorlagen. Die Einstellung des Gleichgewichtszustands erfolgt vonseiten der Ausgangsstoffe genauso wie vonseiten der Reaktionsprodukte.
Das chemische Gleichgewicht ist durch folgende Merkmale gekennzeichnet:
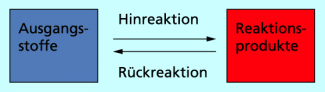
- Hin- und Rückreaktion laufen gleichzeitig nebeneinander ab, sodass der Stoffumsatz unvollständig bleibt.
- Nach der Einstellung des Gleichgewichts bleiben die Konzentrationen der Edukte und Produkte konstant (makroskopisch stationärer Zustand).
- Auf Teilchenebene erfolgt ein ständiger Umsatz (submikroskopisch dynamischer Zustand).
Der Stoffumsatz bei reversiblen chemischen Reaktionen ist immer unvollständig. Diese speziellen umkehrbaren Prozesse sind dadurch gekennzeichnet, dass die Hinreaktion und Rückreaktion gleichzeitig und ungehemmt nebeneinander ablaufen.
Dabei muss die Rückreaktion über den gleiche Übergangszustand erfolgen wie die Hinreaktion. Zudem dürfen keine Energieverluste auftreten, d. h., die Energiebeträge der Hinreaktion und der Rückreaktion müssen identisch sein. Sie unterscheiden sich nur durch das Vorzeichen.
Typische Beispiele für solche reversiblen Reaktionen sind Veresterungen, viele Redoxreaktionen sowie Säure-Base-Reaktionen und Fällungsreaktionen. Bei diesen Reaktionen stellen sich nach einer bestimmten Zeit konstante Konzentrationen an Ausgangsstoffen (Edukten) und Reaktionsprodukten (Produkten) ein.
Voraussetzung für diesen makroskopisch stationären Gleichgewichtszustand ist, dass dem Reaktionssystem kein Stoff entnommen oder dazugefügt wird. Dies ist in isolierten oder geschlossenen thermodynamischen Systemen der Fall, bei denen kein Stoffaustausch mit der Umgebung stattfindet.
Beispiele für geschlossene Systeme sind Rundkolben mit Stopfen oder Rührkessel zur industriellen Herstellung von Seife.
Ein chemisches Gleichgewicht kann sich nur bei reversiblen Reaktionen in geschlossenen oder isolierten thermodynamischen Systemen einstellen.
-
chemisches Gleichgewicht
Die Einstellung des Gleichgewichts lässt sich am besten auf der Teilchenebene nachvollziehen. Betrachten wir dazu die Veresterung von Ethansäure mit Ethanol im Kolben mit Rückflusskühler:
Zu Beginn der Reaktion liegen nur Alkohol- und Säuremoleküle vor. Sie werden schnell zu Ester- und Wassermolekülen umgesetzt, sodass die Anzahl der Eduktteilchen abnimmt. Dadurch finden mit der Zeit immer weniger wirksame Zusammenstöße zwischen Alkohol- und Säuremolekülen statt.
Gleichzeitig steigt die Anzahl der Ester- und Wassermoleküle an, die in der Rückreaktion zu Alkohol- und Säuremolekülen umgesetzt werden können. Da die Anzahl der Produktteilchen zunimmt, erfolgen pro Zeiteinheit mehr wirksame Zusammenstöße zwischen ihnen. Infolgedessen entstehen mehr Eduktteilchen.
Nach einer bestimmten Zeit bilden sich pro Zeiteinheit genauso viele Teilchen der Edukte wie Teilchen der Produkte. Hin- und Rückreaktion laufen mit gleich großer Geschwindigkeit ab.
Nach dieser Einstellzeit des chemischen Gleichgewichts bleiben die Gleichgewichtskonzentrationen cGG aller Reaktionsteilnehmer konstant. Dennoch findet auf der Teilchenebene weiterhin eine ständige Umwandlung von Eduktmolekülen zu Produktmolekülen bzw. von Produktmolekülen zu Eduktmolekülen statt. Es bildet sich ein dynamischer Zustand heraus.
-
Einstellung des chemischen Gleichgewichts