Ion
Ionen sind elektrisch geladene Teilchen, aus denen salzartige Stoffe aufgebaut sind. Sie entstehen dadurch, dass aus der Atomhülle eines zuvor neutralen Atoms Elektronen abgegeben oder aufgenommen werden. Durch Elektronenabgabe oder Elektronenaufnahme entsteht im Vergleich zum elektrisch positiv geladenen Atomkern ein Ladungsüberschuss oder ein Ladungsmangel.
Negativ geladene Ionen heißen Anionen, positiv geladene Ionen Kationen.
Ionen sind elektrisch geladene Teilchen, aus denen salzartige Stoffe aufgebaut sind. Ionen entstehen dadurch, dass aus der Atomhülle eines zuvor neutralen Atoms Elektronen abgegeben oder aufgenommen werden.
Wird ein Elektron aufgenommen, so entsteht ein negativ geladenes Ion. Solche Ionen heißen Anionen. Anionen werden bevorzugt durch Nichtmetallatome gebildet, die durch die Aufnahme von Elektronen eine stabile Edelgaskonfiguration, z. B. eine Achterschale, erreichen können. Beispiele für solche Anionen sind Chlorid-, Bromid- oder Sulfid-Ionen.
-
Natrium-Ion – ein abgegebenes Außenelektron; Chlorid-Ion – ein aufgenommenes Außenelektron
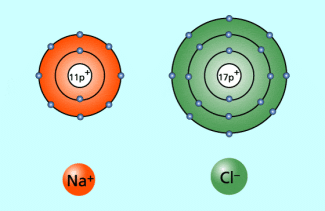
Metallatome erreichen dagegen eine stabile Edelgaskonfiguration viel leichter, indem sie Elektronen abgeben. Dabei entstehen positiv geladene Ionen, die man Kationen nennt.
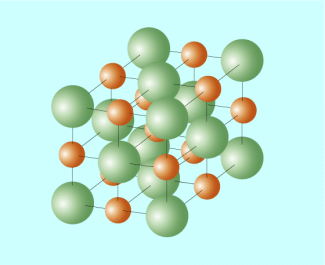
Ein Salz wie Natriumchlorid (NaCl, Kochsalz) besteht aus Natrium-Ionen und Chlorid-Ionen, die in einem Gitter angeordnet sind (Bild 2). Beim Auflösen in Wasser wird dieses Gitter abgebaut. Die Ionen werden dabei von Wasserstoffmolekülen umhüllt (solvatisiert). Dieser Vorgang wird als Dissoziation bezeichnet.
NaCl(sol) → Na+ (aq) + Cl- (aq)
Aber auch beim Lösen von Chlorwasserstoff (HCl) in Wasser spricht man von Dissoziation. Die Verbindung HCl ist jedoch eine Molekülsubstanz mit einer polaren Atombindung. Die Ionen werden hier erst unter Dissoziation der Atombindung durch die Protolysereaktion mit dem Wasser gebildet.
HCl + 2 H2O → H3O+ (aq) + Cl- (aq)
-
Gittermodell eines Natriumchlorid-Kristalls
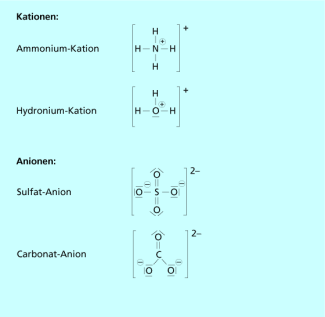
Ionen wie Natrium-Ionen oder Chlorid-Ionen, die nur eine Atomsorte enthalten, bezeichnet man auch als einatomige Ionen oder auch Atom-Ionen.
Viele Salze enthalten aber auch komplexere Ionen, die aus mehreren Atomen bestehen. Die Atome sind untereinander durch Atombindungen verknüpft. Damit alle Atome eine stabile Edelgaskonfiguration ausbilden können, müssen jedoch oft noch zusätzlich Elektronen aufgenommen werden.
Daraus resultiert ein elektrisch negativ geladenes Molekül-Ion, dass mit einem Kation ein Salz bildet. Beispiele für mehratomige Ionen bzw. Molekül-Ionen sind Hydroxid-, Sulfat- oder Ammonium-Ionen (Bild 3). Letztere sind positiv geladene Molekül-Ionen.
-
Molekül-Ionen sind elektrisch geladene Teilchen, die aus mehreren Atomen bestehen. Diese sind durch Atombindungen untereinander verbunden.