Redoxreaktionen
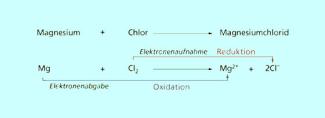
Bei Redoxreaktionen laufen Oxidation und Reduktion gleichzeitig ab. Redoxreaktionen sind durch einen Elektronenübergang gekennzeichnet. Bei der Teilreaktion Oxidation werden Elektronen abgegeben. Bei der Teilreaktion Reduktion werden Elektronen aufgenommen. Bevor die Elektronenübertragung bekannt war, ging man davon aus, dass Redoxreaktionen immer mit dem Übergang von Sauerstoff verbunden sind.
Redoxreaktionen im engeren Sinn
Verbinden sich Elemente mit Sauerstoff zu einem Reaktionsprodukt, nennt man diese chemische Reaktion allgemein Oxidation. Die Reaktionsprodukte heißen Oxide.
Beispiele
Durch Umkehrung des Oxidationsprozesses kann z. B. aus einem Metalloxid das Metall zurückgewonnen werden.
Diese Reaktion heißt Reduktion.
Die Reduktion ist eine chemische Reaktion, bei der einer Verbindung, z. B. einem Metalloxid, der Sauerstoff entzogen wird. Das Metalloxid wird zum Metall zurückgeführt (lat. reducere - zurückführen).
-
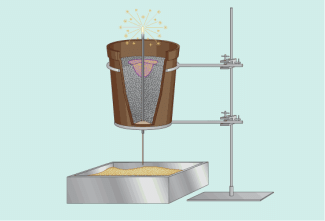
Modellversuch zum aluminiothermischen Schweißen
Die Reduktion kann demnach als Umkehrung der Oxidation angesehen werden.
Um z. B. den im Eisen(II)-oxid enthaltenen Sauerstoff zu entfernen, also das Eisen(II)-oxid zu reduzieren, benötigt man einen Stoff, der Sauerstoff noch stärker an sich binden kann, als Eisen. Man braucht ein Reduktionsmittel.
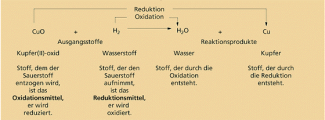
Ein Reduktionsmittel ist ein Stoff, der während einer chemischen Reaktion anderen Stoffen Sauerstoff entzieht, sie reduziert.
Das Reduktionsmittel verbindet sich dabei mit dem Sauerstoff, es wird gleichzeitig oxidiert.
-
Oxidation und Reduktion
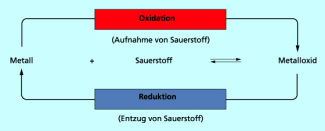
Stoffe, die Sauerstoff abgeben, sind Oxidationsmittel. Sie werden durch die Sauerstoffabgabe reduziert.
Ein Oxidationsmittel ist ein Stoff, der Sauerstoff an andere Stoffe abgeben kann und diese Reaktionspartner dadurch oxidiert.
Bei solchen chemischen Reaktionen sind Oxidation und Reduktion nicht mehr voneinander zu trennen, beide laufen gleichzeitig ab.
Dem einen Stoff wird Sauerstoff entzogen, er gibt ihn ab - dies bezeichnet man als Reduktion. Gleichzeitig nimmt der andere Stoff Sauerstoff auf - dies bezeichnet man als Oxidation.
Oxidation und Reduktion stellen eine nicht zu trennende Einheit dar.
Eine chemische Reaktion, bei der Oxidation und Reduktion gleichzeitig ablaufen, nennt man Redoxreaktion.
-
Redoxreaktion zwischen Kupfer(II)-oxid und Wasserstoff
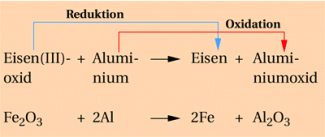
Ein Beispiel für eine Redoxreaktion im engeren Sinne ist die Reaktion zwischen Aluminium und Eisen(III)-oxid.
Da Aluminium Sauerstoff stärker bindet als Eisen, kann es auch als Reduktionsmittel für die Reduktion von Eisen(III)-oxid eingesetzt werden.
Während der Reaktion nimmt das Aluminium Sauerstoff auf (Oxidation) und reagiert zum Aluminiumoxid. Es wirkt als Reduktionsmittel. Eisen(III)-oxid gibt Sauerstoff ab und wird zu Eisen. Es wirkt als Oxidationsmittel.
Diese Reaktion nutzt man aus, um kleinere Mengen Eisen herzustellen. Das Verfahren wird z. B. beim Gleisbau für Eisen- und Straßenbahn (siehe Bild 1) eingesetzt, um Schienen zu verbinden.
Man bezeichnet es als aluminothermisches Schweißen oder als Thermitverfahren.
Redoxreaktion im erweiterten Sinn
Betrachtet man die Reaktion von Aluminium mit Eisen(III)-oxid genauer, so findet sich nicht nur ein Übergang des Sauerstoffs, sondern es werden Elektronen zwischen den Reaktionspartnern ausgetauscht. Aluminium besteht aus Aluminiumatomen. Aluminiumatome besitzen drei Außenelektronen. Durch Abgabe dieser Außenelektronen entstehen Aluminium-Ionen.
Elektronenabgabe:
Die abgegebenen Elektronen werden von den Eisen(III)-Ionen (im Eisenoxid) aufgenommen. Diese werden dadurch zu Eisenatomen.
Elektronenaufnahmen:
Bei dieser Reaktion erfolgt ein Elektronenübergang.
Betrachtet man die Reaktion von Eisen mit Kupfer(II)-Ionen, bei der kein Sauerstoff beteiligt ist, so findet auch hier ein Elektronenübergang statt. Eisen gibt Elektronen an die Kupfer(II)- Ionen ab.
Redoxreaktionen sind nicht unbedingt an den Übergang von Sauerstoff gebunden.
-
Eisen(III)-oxid wird durch Aluminium reduziert.
Die Redoxreaktion ist eine Reaktion mit Elektronenübergang.
Bei der Teilreaktion Oxidation erfolgt eine Elektronenabgabe (bei Beteiligung von Sauerstoff eine Sauerstoffaufnahme). Bei der Teilreaktion Reduktion erfolgt eine Elektronenaufnahme (bei Beteiligung von Sauerstoff eine Sauerstoffabgabe).
Das Oxidationsmittel ist der Reaktionspartner, der Elektronen aufnimmt.
Das Reduktionsmittel ist der Reaktionspartner, der Elektronen abgibt.
Teilchen, die Elektronen abgeben, heißen Elektronendonatoren (lat. donare = schenken).
Teilchen, die Elektronen aufnehmen, sind Elektronenakzeptoren (lat. acceptare - empfangen).
Reaktionen, bei denen Elektronenabgabe und Elektronenaufnahme gleichzeitig ablaufen, sind Reaktionen mit Elektronenübergang.
-
Elektronenübergang bei der Reaktion von Magnesium mit Chlor