Wasser – ein Stoff mit besonderen Eigenschaften
Wasser ist das am häufigsten vorkommende Oxid, das in der Natur in allen drei Aggregatzuständen anzutreffen ist. Es ist Lebensraum für viele Organismen und Lösungsmittel für eine Vielzahl von Verbindungen wie Säuren, Basen oder Salze. Deshalb fungiert Wasser als Transportmittel in der Natur, aber auch selbst als Ausgangsstoff für eine Vielzahl chemischer Reaktionen, z. B. die Fotosynthese.
Aufgrund seiner chemischen Bindungsverhältnisse weist Wasser einige außergewöhnliche Eigenschaften auf, die man als Anomalie des Wassers bezeichnet.
Infolge seiner herausragenden Bedeutung für das Leben auf der Erde ist Wasser ein wertvoller Rohstoff. Aus diesem Grund ist es notwendig, Chemikalieneinträge in die Gewässer zu vermeiden und die Abwässer aus industriellen Prozessen aber auch aus privaten Haushalten einer speziellen Abwasserbehandlung zu unterziehen.
Wasser – ein Stoff mit besonderen Eigenschaften
Zur Wasserhülle der Erde gehört das Wasser der Meere, das Wasser auf den Landflächen in Seen, Mooren, Flüssen, Teichen usw., das Wasser innerhalb der Lufthülle (Atmosphäre) und auch das Wasser innerhalb der Gesteinshülle (Lithosphäre). Das Gesamtwasservolumen wird auf 1,454·109 km3; geschätzt. Nur 2,47 % davon sind Süßwasser. Das Wasser auf unserer Erde befindet sich in einem Kreislauf.
Wasser ist für das Leben auf der Erde von großer Bedeutung. Es ist Lebensraum für viele unterscheidliche Organismen sowohl im Meerwasser als auch im Süßwasser.
Wasser ist ein gutes Lösungsmittel nicht nur für Salze sondern auch für viele andere Stoffe. Das ist sehr wichtig für das Leben auf der Erde. Beispielsweise liegen die Nährsalze im Boden in Ionen, also in gelöster Form, vor. Nur in dieser Form können die Pflanzen die Stoffe über die Wurzeln aus dem Boden aufnehmen.
Wasser ist ein Hauptbestandteil unseres Bluts. Da sich viele Stoffe in ihm lösen, ist es auch als Transportmittel innerhalb des Körpers gut geeignet. Auch in Flüssen und Bächen werden viele Stoffe transportiert.
Ohne Wasser können viele pflanzliche Samen nicht quellen (Quellungsmittel). Die Quellungsvorgänge bilden aber die Voraussetzung für das Keimen der Samen.
Wasser bildet einen wesentlichen Ausgangsstoff für chemische und biochemische Reaktionen, z. B. für die Fotosynthese.
Wasser trägt zur Festigkeit von krautigen Pflanzen bei, denn durch das Wasser in den Zellwänden wird der notwendige Zellinnendruck (Turgor) bewirkt, der auf die Zellwände drückt. Das merkt man, wenn eine Blume durch Wasserverlust welkt und Blätter und Blüten nach unten sinken.
Viele biochemische Reaktionen können nur im Wasser stattfinden. Es ist also Reaktionsraum. Unser Körper besteht zu einem großen Teil aus Wasser und ein starker Wasserverlust wird lebensbedrohlich.
Der durchschnittliche Wassergehalt eines erwachsenen Menschen beträgt über 70 %. Der tägliche Wasserumsatz beläuft sich etwa auf 2,5 l. Als Trinkflüssigkeit werden etwa 1 200 ml (empfohlen werden mindestens 2 000 ml) und mit der Nahrung etwa 1 000 ml aufgenommen. Als Stoffwechselprodukte entstehen etwa 300 ml, als Schweiß werden 600 ml, als Harn 1 000 ml, im Kot 100 ml und durch die Atemluft 300 ml ausgeschieden.
Trinkwasser und Abwasser
An Trinkwasser werden ganz besondere Anforderungen gestellt. Es soll klar, geruchlos und geschmacksfrei sein und darf keine Krankheitskeime enthalten. Außerdem dürfen vorgeschriebene Grenzwerte an gelösten Stoffen nicht überschritten werden (z. B. nicht mehr als 50 mg Nitrat pro Liter Wasser).
Unser Trinkwasser wird hauptsächlich aus Grundwasser gewonnen, nur zu einem geringen Teil aus Quellwasser. In manchen Gegenden wird auch Oberflächenwasser genutzt. Seine Aufbereitung ist jedoch aufwändiger.
Trinkwassergewinnung aus dem Grundwasser
Tiefbrunnen: Bohrungen dringen bis zu den Grundwasserschichten vor.
Kiesfilter: Wasser aus den Tiefbrunnen wird durch Kies gefiltert, um feinste Verunreinigungen zu entfernen.
Aktivkohlefilter: Wasser aus dem Kiesfilter wird bei Bedarf von den eventuell vorhandenen Verunreinigungen befreit.
Wasser, das im Haushalt, in der Industrie und in der Landwirtschaft genutzt wurde, wird durch Verunreinigung zu Abwasser. Geht man von einem durchschnittlichen Verbrauch von 128 l pro Kopf aus, würden in einer Stadt mit 100 000 Einwohnern ca. 12 800 m3 (1 m3 = 1 000 l) am Tag anfallen. Hinzu kommen noch beträchtliche Mengen aus Industrie und Wirtschaft. Das Abwasser ist durch Staub- und Schmutzteilchen, durch Fäkalien, Speisereste, Wasch- und Spülmittel u. a. verunreinigt. Es muss so aufbereitet werden, dass die Einleitung in die Gewässer erfolgen kann, ohne das biologische Gleichgewicht der Gewässer zu stören.
Besondere Eigenschaften von Wasser und die Folgen
| Eigenschaft | Besonderheit | Ökologische Bedeutung |
| Dichte | Maximum bei 4 °C (1,0 g/ml), Eis hat kleinere Dichte (0,92 g/ml) | Seen frieren von oben nach unten zu; Umschichtung im Frühjahr und Herbst; Sprengwirkung bei Verwitterung |
| spezifische Wärmekapazität | höchste bei Flüssigkeiten: 4,18 kJ * kg-1 * K-1 | Ozeane als Wärmespeicher; ausgleichende klimatische Wirkung |
| Schmelzwärme | sehr hoch: 335 kJ * kg-1 | ausgleichend beim Zufrieren und Auftauen von Gewässern |
Verdampfungs- wärme | höchste bei Flüssigkeiten: 2 282 kJ * kg-1 | kühlender Effekt bei Transpiration |
| Wärmeleitung | höchste bei Flüssigkeiten, aber klein im Vergleich zu Metall H2O: 0,6; Glas: 1; Cu: 380 | wichtig für Energiehaushalt in Lebewesen; Schichtung von Seen im Sommer |
| Oberflächen-spannung | höchste bei Flüssigkeiten: 0,072 N/m | Wassertransport durch Kapillarkräfte in Pflanzen |
| Polarität des Lösungsmittels | höchste Dielektrizitäts-konstante aller Flüssigkeiten | löst viele polare Stoffe; Lösung über großen Temperaturbereich stabil |
chemische Stabilität | Autoprotolyse: | pH-Wert ist wichtig für viele Lebensprozesse |
Wasser ist ein Stoff mit zahlreichen besonderen Eigenschaften, die in der Summe sicher mit verantwortlich dafür sind, dass es überhaupt Leben auf der Erde gibt.
Im Gegensatz zu fast allen anderen Stoffen hat die Flüssigkeit eine höhere Dichte als der Feststoff und Wasser hat nicht am Schmelzpunkt bei 0 °C seine größte Dichte, sondern erst bei 4 °C (Dichteanomalie des Wassers).
Auch die thermischen Eigenschaften sind ungewöhnlich, die chemische Stabilität und die Ausbildung von Wasserstoffbrückenbindungen sind entscheidend für die Strukturen im Organismus.
Wasser dehnt sich beim Gefrieren aus. Der Effekt spielt auch in der Natur eine große Rolle. Als Sonderform der Temperaturverwitterung gilt die Frost(sprengungs)verwitterung. Hier wird die Erosion von Gesteinen durch das häufige Auftauen und Wiedergefrieren des sich in den Hohlräumen des Gesteins befindlichen Wassers verursacht. Dadurch wird der Zerfall des Gesteins stark beschleunigt. In Gebieten mit tageszeitlichem Frostwechsel, beispielsweise in den subpolaren Gebieten der Erde und in den Hochgebirgen, ist diese Verwitterungsform für die Gestaltung des Reliefs besonders bedeutsam.
Spezifische Wärmekapazität
Nicht zuletzt sind die Verdampfungswärme von Wasser und seine spezifische Wärmekapazität viel größer als bei anderen Stoffen. Ersteres spielt bei der Temperaturregulation unseres Körpers eine Rolle, wo der Körper sich durch Schwitzen vor Überhitzung schützt. Letzteres ist sogar für die „Temperaturregelung“ unseres Planeten wesentlich: Große Meeresströmungen, z. B. der Golfstrom, beeinflussen das Klima in vielen Ländern. So transportiert z. B. der Golfstrom warmes Wasser und damit Wärme aus dem mittelamerikanischen Bereich (Karibik) quer über den Atlantik bis zu den Küsten Irlands, Englands, Schottlands, Norwegens und Russlands. Folgen davon sind beispielsweise, dass an der Westküste Englands Palmen wachsen und die norwegische Westküste stets eisfrei bleibt. Das gilt selbst für einen so weit nördlich gelegenen Hafen wie Murmansk in Russland.
Die hohe Schmelzwärme von Eis führt dazu, dass Gewässer im Winter verzögert zufrieren, andererseits aber das Eis im Frühjahr wieder verzögert schmilzt. Dadurch wird ein ausgleichender Effekt bewirkt.
Die große Oberflächenspannung bewirkt, dass Wasser in Kapillaren entgegen der Schwerkraft nach oben steigt. Dieser Effekt sorgt zusammen mit dem osmotischen Druck für den Transport von Wasser und Nährstoffen in den Pflanzen von den Wurzeln zu den Blättern.
Die Bildung starker Wasserstoffbrückenbindungen zwischen den Wassermolekülen ist dafür verantwortlich, dass Wasser in der Reihe der Wasserstoffverbindungen der 6. Hauptgruppe einen ungewöhnlich hohen Siedepunkt besitzt. Durch Wasserstoffbrückenbindungen werden auch die beiden Einzelstränge der DNA in der Doppelhelix zusammengehalten.
Bau des Wassermoleküls
Wasser ist aufgrund seiner Molekülstruktur ein Stoff mit außergewöhnlichen Eigenschaften. Die Ursache für die besonderen Eigenschaften des Wassers sind in der Molekülstruktur des Stoffes, in den Kräften, die zwischen den Molekülen wirken und in der sich daraus ableitenden räumlichen Anordnung der Teilchen bei verschiedenen Temperaturen zu finden.
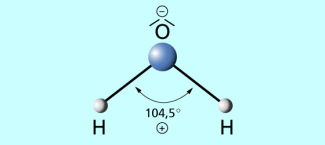
Wassermoleküle bestehen jeweils aus einem Sauerstoffatom und zwei Wasserstoffatomen. Die beiden nicht bindenden Elektronenpaare des Sauerstoffatoms führen zu einer Deformation des Tetraederwinkels (ideal 109,5°) zwischen den Wasserstoffatomen und dem eingeschlossenen Sauerstoffatom. Der Winkel beträgt daher im Wassermolekül 104,5°.
Des weiteren bewirkt das Sauerstoffatom (hoher EN-Wert), dass die herausgebildeten Elektronenpaarbindungen zu den Wasserstoffatomen stark polarisiert werden. Die Elektronendichte am Sauerstoffatom wird stark erhöht, an den Wasserstoffatomen stark verringert.
Durch die oben beschriebene Winkelung und die darunter aufgezeigte Polarisierung zeigt das Wassermolekül alle Eigenschaften eines Dipols.
-
Bau des Wassermoleküls als Dipol (Kugel-Stab-Modell)
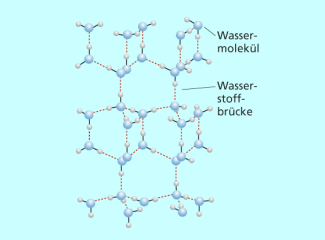
Unter 0 °C bilden Wassermoleküle ein Molekülgitter. In ihm ist jedes Sauerstoffatom tetraedisch von vier Wasserstoffatomen umgeben. Zu den „eigenen“ Wasserstoffatomen existieren zwei polarisierte Atombindungen und zu den beiden anderen Wasserstoffatomen, die von benachbarten Wassermolekülen stammen, werden Wasserstoffbrückenbindungen ausgebildet.
Diese Anordnung ergibt ein weitmaschiges Gitter mit durchgängigen sechseckigen Hohlräumen. Die Dichte des so entstehenden Stoffes Eis ist geringer als die des flüssigen Wassers. Eis schwimmt oben.
Erhöht man die Temperatur, beginnt also das Eis zu schmelzen, zerbricht das Gitter teilweise. Einzelne Wasserstoffbrückenbindungen werden gelöst.
Jedoch auch in flüssigem Wasser sind Teile der ursprünglichen Gitterstruktur nachweisbar. Man bezeichnet diese als Cluster.
Da sich im flüssigen Zustand frei bewegliche Wassermoleküle in noch vorhandene Gitterstrukturen einlagern, nimmt die Dichte zu und erreicht erst bei 4 °C den größten Wert. 1 cm3; Wasser wiegt dann 1 g.
Bei weiterer Temperaturerhöhung nimmt wie bei allen anderen Flüssigkeiten die Bewegungsenergie der Moleküle zu und die Abstände der Teilchen zueinander vergrößern sich. Oberhalb 4 °C verringert sich die Dichte des Wassers wie bei anderen Flüssigkeiten auch.
Die Wasserstoffbrückenbindungen zwischen den Wassermolekülen und die Anziehungskräfte zwischen Dipolen (Dipol-Dipol-Wechselwirkungen) führen dazu, dass Wasser bei Raumtemperatur noch flüssig ist und nicht gasförmig wie Schwefelwasserstoff oder Ammoniak. Erst bei 100 °C geht das Wasser in den gasförmigen Aggregatzustand über, was für das Leben auf der Erde von herausragender Bedeutung ist.
Durch den Dipolcharakter können die Wassermoleküle sehr gut Ionen hydratisieren und damit ionische Verbindungen lösen. Andererseits sind auch verschiedene organische Verbindungen mit polaren Gruppen in Wasser löslich. Die Löslichkeit z. B. der Zucker ist durch die Ausbildung von Wasserstoff-Brückenbindungen zu den OH-Gruppen der Zuckermoleküle verständlich.
-
In der Struktur von Eis ist jedes Sauerstoffatom von vier Wasserstoffatomen umgeben, von denen zwei über Wasserstoffbrückenbindungen gebunden sind.
Suche nach passenden Schlagwörtern
- Molekülstruktur
- Klärwerk
- Oberflächenwasser
- Aggregatzustand
- Bedeutung
- Schmelzpunkternierdrigung
- Trinkwasseraufbereitung
- Molekülbau
- Frostsprengungsverwitterung
- Verdampfungswärme
- Süßwasser
- spezifische Wärmekapazität
- Anomalie des Wassers
- Wasser
- Frostverwitterung
- Dichteanomalie
- Dipol
- Trinkwasser
- Abwasserreinigung
- Abwasseraufbereitung
- Meerwasser
- Grundwasser
- Abwasser
- Trinkwassergewinnung
- Wasserstoffbrückenbindung

