Kalorimetrische Messungen
Unter dem Begriff „kalorimetrische Messungen“ werden solche Messungen zusammengefasst, bei denen man beispielsweise die spezifische Wärmekapazität eines Stoffes, seine Schmelzwärme oder den spezifischen Heizwert eines Brennstoffes und damit wichtige Stoffkonstanten bestimmen kann. Genutzt wird dazu ein Kalorimeter.
Für die Messung der spezifischen Wärmekapazität oder der Schmelzwärme erfolgt im Kalorimeter eine Mischung von Stoffen und damit ein Temperaturausgleich. Aus den gemessenen Temperaturdifferenzen und aus der Energiebilanz lässt sich die jeweilige Stoffkonstante ermitteln.
Zur Bestimmung des spezifischen Heizwertes wird eine bestimmte Menge eines Brennstoffes verbrannt und die dabei abgegebene Wärme indirekt bestimmt.
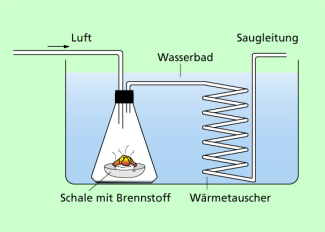
Ein Kalorimeter ist in einfacher Form in Bild 1 dargestellt. Um den Wärmeaustausch mit der Umgebung möglichst gering zu halten, sollte das Kalorimetergefäß gut wärmeisoliert sein und auch einen Deckel besitzen. Der Rührer ist erforderlich, um eine schnelle Durchmischung und damit auch einen schnellen Temperaturausgleich zu erzielen. Mit dem Thermometer kann die Temperatur bestimmt werden.
Die Wärmekapazität eines Kalorimeters
Für genaue Messungen ist zu berücksichtigen, dass z.B. bei der Mischung von Flüssigkeiten verschiedener Temperatur auch das Kalorimeter Wärme aufnimmt oder abgibt. Das kann man von vornherein berücksichtigen, wenn man in die Energiebilanz die Wärmekapazität eines Kalorimeters mit einbezieht. Die Größe wird auch als Wasserwert bezeichnet.
Allgemein versteht man in der Physik unter der Wärmekapazität eines Körpers die Wärme, die ihm zugeführt werden muss oder die er abgibt, wenn sich seine Temperatur um 1 K ändert. Für die Wärmekapazität C gilt:
Die Wärmekapazität eines Kalorimeters lässt sich experimentell ermitteln, indem man z.B. eine bestimmte Menge kaltes Wasser in ein Kalorimeter füllt, eine bestimmte Menge warmes Wasser hinzugibt und die Mischungstemperatur bestimmt. In diesem Falle nimmt das Kalorimeter Wärme vom warmen Wasser auf. Die Energiebilanz lautet:
Beachte: Die experimentell ermittelte Wärmekapazität eines Kalorimeters ist vom Füllstand abhängig. Will man Messfehler möglichst klein halten, dann sollte man bei nachfolgenden Experimenten bei dem Füllstand des Kalorimeters arbeiten, für den man die Wärmekapazität bestimmt hat. Man kann auch umgekehrt herangehen und sich zunächst überlegen, bei welchem Füllstand man Messungen durchführen will und für diesen Füllstand im Vorversuch die Wärmekapazität bestimmen.
-
Einfaches Kalorimeter für kalorimetrische Messungen
Bestimmen der spezifischen Wärmekapazität eines festen Körpers
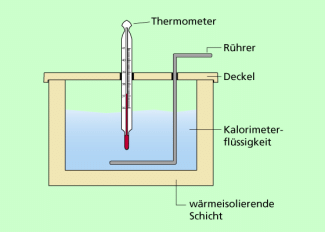
Bild 2 zeigt vereinfacht eine Experimentieranordnung, mit der man die spezifische Wärmekapazität eines festen Körpers bestimmen kann. Wir gehen davon aus, dass die Wärmekapazität C des Kalorimeters in einem Vorversuch ermittelt wurde und somit bekannt ist.
Dann kann man folgendermaßen vorgehen: Das Kalorimeter wird mit einer bestimmten Menge Wasser gefüllt. Die Temperatur des Wassers wird bestimmt. Damit kennt man die Größen
Nun wird ein fester Körper bestimmter Masse auf eine bestimmte Temperatur gebracht, indem man ihn z.B. in siedendes Wasser oder heißes Wasser bestimmter Temperatur taucht. Mit dieser Temperatur wird er in das Wasser im Kalorimeter gebracht. Dort kommt es zu einem Temperaturausgleich: Das kalte Wasser und das Kalorimeter nehmen Wärme auf, der heiße Körper gibt Wärme ab. Es stellt sich eine Mischungstemperatur ein, die gemessen werden kann. Die Energiebilanz für diesen Vorgang lautet:
Bestimmen der spezifischen Schmelzwärme von Eis
Die Experimentieranordnung entspricht der in Bild 2 dargestellten. Statt eines festen Körpers wird eine bestimmte Menge Eis in das Wasser gegeben. Dieses Eis sollte eine Temperatur von 0 °C haben und gut abgetrocknet sein, damit die Ergebnisse nicht verfälscht werden. Eis von 0 °C erkennt man daran, dass es im Unterschied zu Eis mit niedrigerer Temperatur durchscheinend ist.
Bringt man das Eis in das Wasser, dann schmilzt es. Dazu ist eine bestimmte Schmelzwärme erforderlich. Darüber hinaus erwärmt sich das zu Wasser gewordene Eis. Das ursprünglich im Kalorimeter befindliche Wasser und auch das Kalorimeter selbst kühlen sich ab. Damit ergibt sich folgende Energiebilanz:
-
Kalorimetrische Messung zur Bestimmung der spezifischen Wärmekapazität eines festen Körpers
Bestimmen des Heizwertes eines Brennstoffes
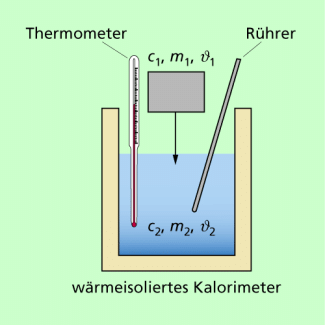
Der spezifische Heizwert eines Brennstoffs kann in einem sogenannten Verbrennungskalorimeter bestimmt werden, die es in unterschiedlichen Bauformen gibt. Bild 3 zeigt eine einfache Variante.
In dem Kalorimeter wird eine bestimmte Menge Brennstoff verbrannt. Durch die Verbrennungswärme wird das Wasser erwärmt. Dann ergibt sich folgende Energiebilanz:
Ermittelt und angegeben wird in der Regel der untere Heizwert, also der Wert, in den auch die Verdampfung des im Brennstoff enthaltenen Wassers eingeht. Das ist zugleich der Heizwert, der für die technische Nutzung entscheidend ist.
Für alle kalorimetrischen Messungen gilt:
Die Versuchsanordnung und die Versuchsdurchführung sollte so gewählt werden, dass die entstehenden Temperaturdifferenzen möglichst groß sind. Bei kleinen Temperaturdifferenzen können leicht Messfehler von über 50 % entstehen.
-
Kalorimeter zum Bestimmen des Heizwertes eines Brennstoffs