Periodensystem der Elemente
Das Periodensystem der Elemente ist heute ein ganz wichtiges Arbeitsmittel für jeden, der sich mit der Chemie beschäftigt. In ihm sind die Elemente in Abhängigkeit von ihrem Bau angeordnet. Daher kann man aus dem Periodensystem wesentliche Fakten zum Atombau der Elemente und daraus resultierend über die Eigenschaften der Elementsubstanzen ablesen.
An der Entwicklung des Periodensystems der Elemente haben viele bekannte Wissenschaftler mitgearbeitet. Klicken Sie auf das nebenstehende Bild, um ein Vollbild des Periodensystems zu sehen. Dort können Sie für jedes Element zahlreiche Informationen abrufen. Durch Klicken auf die einzelnen Elementsymbole erhalten Sie Informationen zu wichtigen Eigenschaften der Elektronenkonfiguration, Vorkommen, Verbindungen und den wichtigsten Anwendungen. Außerdem sind jeweils die wichtigsten Stoffkonstanten und die Häufigkeit des Vorkommens in der Natur angegeben. Dazu gehören auch eine Übersicht über die häufigsten Isotope der einzelnen Elemente und ein kurzer historischer Abriss über die Entdeckung des jeweiligen Elements.
Die Anordnung der Elemente im Periodensystem
Heute sind über 100 Elemente bekannt. Klicken Sie auf die nebenstehende Abbildung, um das Vollbild zu sehen. Dort können Sie für jedes Element zahlreiche Informationen über wichtige Eigenschaften der Elementsubstanz, wesentliche Stoffkonstanten, grundlegende Aussagen zum Atombau, Vorkommen, Bedeutung und einen kurzen geschichtlichen Abriss der Entdeckung abrufen.
Mithilfe des Periodensystems der Elemente wird Ordnung in die Vielfalt gebracht. Wo ein Element im Periodensystem zu finden ist, hängt vom Bau seiner Atome ab.
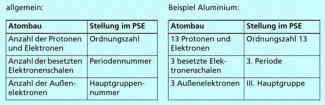
Im Periodensystem der Elemente sind die Elemente nach steigender Protonenzahl angeordnet. Die Protonenzahl entspricht jeweils der Ordnungszahl. Da die Anzahl der Protonen und der Elektronen eines Atoms gleich ist, kann man somit aus der Ordnungszahl die Zahl der Protonen und die Gesamtzahl der Elektronen ablesen.
Die Elemente sind im Periodensystem in sieben waagerechten Reihen angeordnet, den Perioden. So steht Wasserstoff in der ersten Periode. Aluminium ist in der dritten Perioden zu finden. Die jeweilige Periodenummer spiegelt die Anzahl der besetzten Elektronenschalen der Atome des Elements wieder - Kohlenstoffatome haben nur zwei besetzte Elektronenschalen, Aluminiumatome hingegen drei.
Außer in den Perioden sind die Elemente noch in Gruppen zusammengefasst, die senkrecht angeordnet sind. Es existieren acht Hauptgruppen und acht Nebengruppen. Sie sind jeweils durch römische Zahlen gekennzeichnet. Die Hauptgruppennummer entspricht der Anzahl der Außenelektronen (Valenzelektronen) der jeweiligen Atome. Aus dem Periodensystem der Elemente ist demzufolge abzulesen, dass Kohlenstoffstoffatome vier Außenelektronen besitzen und Aluminiumatome drei Außenelektronen (Bild 3).
-
Einordung der Elemante im PSE; allgemein und Beispiel Aluminium
Suche nach passenden Schlagwörtern
- Radon
- Cadmium
- Aluminium
- Ruthenium
- Mangan
- Natrium
- Lithium
- Mendelevium
- Krypton
- Beryllium
- Wasserstoff
- Fermium
- Gallium
- Chromium
- Polonium
- Atombau
- Neptunium
- Schwefel
- PSE
- Silicium
- Lawrencium
- Gold
- Xenon
- Eisen
- Hassium
- Energieniveauschema
- Rhenium
- Actinium
- Dubnium
- Iridium
- Periode
- Titanium
- Silber
- Lothar Meyer
- Elementeigenschaften
- Technetium
- chemische Symbole
- Californium
- Max von Pettenkofer
- Johann Wolfgang Doebereiner
- Kupfer
- Elementsubstanzen
- Zeichensprache
- Europium
- Sauerstoff
- Berkelium
- Helium
- Thallium
- Hauptgruppe
- Nebengruppe
- Zink
- Bohrium
- Seaborgium
- Neodymium
- Neon
- Francium
- Erbium
- Vanadium
- Zinn
- Rubidium
- Fluor
- Dysprosium
- Periodensystem der Elemente
- Ytterbium
- Osmium
- Elementgruppen
- Yttrium
- Ordnungszahl
- WOLFRAM
- Clemens Winkler
- Bor
- Argon
- Scandium
- Calcium
- Selen
- Chlor
- Terbium
- Kohlenstoff
- Nickel
- Thorium
- Tantal
- John Alexander Newland
- Beguerde Chancourtois
- Gesetz der Periodizität
- Elementsymbol
- Dimitri Iwanowitsch Mendelejew
- Element

