Magnetismus von Komplexverbindungen
Die magnetischen Eigenschaften von Stoffen ergeben sich aus ihrer elektronischen Struktur, insbesondere aus der Anzahl und Anordnung ungepaarter Elektronen. Aus der Untersuchung magnetischer Eigenschaften können daher Aussagen zur Besetzung der Energieniveaus, z. B. in Komplexverbindungen, gezogen werden. Daraus lassen sich wichtige Schlussfolgerungen zu den Bindungsverhältnissen ableiten.
Von einem Magnet, dem Ausgangspunkt eines Magnetfeldes, gehen magnetische Feldlinien aus (Bild 1).
Jeder Magnet hat 2 Pole, den Nordpol und den Südpol. Gleiche Magnetpole stoßen sich ab.
Nach ihrem Verhalten im Magnetfeld werden unterschieden:
- diamagnetische,
- paramagnetische und
- ferromagnetische Stoffe.
Bei diamagnetischen Stoffen weisen die Atome oder Moleküle kein permanentes magnetisches Moment auf, sie enthalten keine ungepaarten Elektronen und werden vom Magnetfeld abgestoßen.
Paramagnetische Stoffe enthalten Atome oder Moleküle mit permanenten magnetischen Momenten, sie verfügen über ungepaarte Elektronen in ihren Energieniveaus. Diese Elementarmagnete stellen sich parallel zur Richtung des von außen angelegten Magnetfeldes ein. Solche Stoffproben werden in das Gebiet größter Feldliniendichte hineingezogen. Diese Teilchen (Molekularmagnete) besitzen ein magnetisches Moment das umso größer ist, je mehr ungepaarte Elektronen vorhanden sind.
Ferromagnetismus weisen Eisen, Kobalt und Nickel sowie einige Legierungen auf, bei denen sich im festen Aggregatzustand ganze Kristallbereiche (sog. Weisssche Bezirke) in Richtung des Feldes einstellen und zu einer permanenten Magnetisierung führen.
Die Untersuchung des magnetischen Verhaltens von Stoffen mit Magnetwaagen ermöglicht eine Aussage über die Art der Besetzung der Energieniveaus von Atomen oder Ionen, z. B. in Komplexverbindungen. Das gemessene magnetische Moment ist umso größer, je mehr ungepaarte Elektronen in der Probe vorliegen. Somit werden paramagnetische Stoffe scheinbar schwerer und diamagnetische Stoffe scheinbar leichter.
In einfachen Fällen lässt sich durch magnetische Messungen qualitativ
feststellen, ob eine Probe ungepaarte Elektronen aufweist und quantitativ ermitteln, wie viele Elektronen in einem Teilchen ungepaart vorliegen. So sind Aussagen über die Elektronenkonfiguration des Zentralteilchens in einer Komplexverbindung zu ermitteln.
Alle Substanzen, deren Atome oder Ionen abgeschlossene Energieniveaus aufweisen, sind diamagnetisch.
-
Veranschaulichung der magnetischen Feldlinien um einen Magneten.

wittayayut - adobe stock
| Beispiele | Elektronenkonfiguration |
| Zink(II)-Ionen | |
| Kupfer(I)-Ionen | |
| Calcium(II)-Ionen |
Sind in den Substanzen Atome oder Ionen mit ungepaarten Elektronen vorhanden, so weisen diese ein magnetisches Moment auf.
| Beispiele | Elektronenkonfiguration |
| Mangan(II)-Ionen | |
| Chrom(II)-Ionen | |
| Eisen(III)-Ionen | |
| Titanium(III)-Ionen |
Wird ein äußeres Magnetfeld angelegt, so richten sich die einzelnen Momente zu einem Gesamtmoment, zu einem Magnetfeld aus, das dem äußeren angelegten Feld gleichgerichtet ist.
Dieses magnetische Verhalten kann z. B. zur Untersuchung der Elektronenkonfiguration von Nebengruppenelementen in Komplexverbindungen herangezogen werden.
-
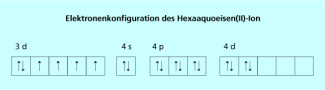
Von den 6 Valenzelektronen des Eisen(II)-Ions sind 4 ungepaart.

Die Ligandenfeldtheorie
Mithilfe der Ligandenfeldtheorie können die speziellen magnetischen Eigenschaften von Komplexen und ihre Farbigkeit anschaulich erklärt werden. Hierbei werden die elektrostatischen Wechselwirkungen zwischen den d-Orbitalen des Zentralteilchens und den Elektronenpaaren der Liganden betrachtet.
Die Zentralteilchen in Komplexen sind normalerweise Nebengruppenelemente. Ihre Valenzelektronen besetzen hauptsächlich die fünf d-Niveaus. Die Aufenthaltsräume (Orbitale) der d-Elektronen haben eine unterschiedliche Geometrie. In einem kartesischen Koordinatensystem sind zwei der fünf d-Orbitale entlang der Achsen und drei der Orbitale entlang der Raumdiagonalen ausgerichtet (Bild 3). Die fünf d-Orbitale weisen die gleiche Energie auf, man sagt, sie sind entartet.
-
Form ausgewählter d-Orbitale
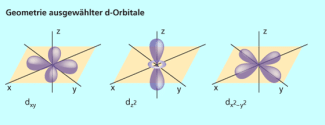
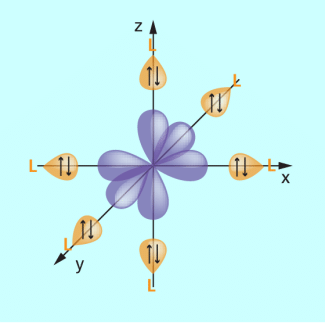
Die Liganden werden modellhaft als punktförmige negative Ladungen betrachtet. Bei sechs Liganden befinden sie sich an den Spitzen eines Oktaeders auf den Achsen des kartesischen Koordinatensystems (Bild 4).
Da sich auf den Achsen die Orbitale des Zentralions befinden, wird es zu einer stärkeren Wechselwirkung der negativ geladenen Liganden mit diesen Orbitalen kommen. Die Wechselwirkung mit den Orbitalen , deren Ausrichtung zwischen den Achsen des Koordinatensystems erfolgt, ist geringer.
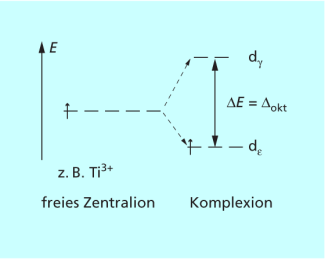
Die elektrostatische Abstoßung zwischen den Liganden und den Elektronen in den d-Orbitalen entlang der Achsen ist größer als die Abstoßung entlang der Raumdiagonalen. Im oktaedrischen Ligandenfeld bilden sich daher aus den entarteten, d. h. energetisch gleichwertigen fünf d-Orbitalen zwei Gruppen von Energieniveaus.
Die drei Orbitale , die als bezeichnet werden, sind energetisch abgesenkt, also stabilisiert. Die zwei Orbitale , die , werden dagegen energetisch angehoben, also destabilisiert.
-
Die Annäherung der Liganden an die d-Orbitale und somit ihre Wechselwirkung mit ihnen ist bei oktaedrischen Komplexen unterschiedlich stark.
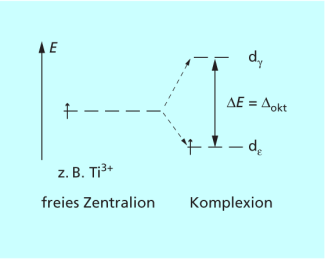
Die Energiedifferenz zwischen den beiden Gruppen von Orbitalen ist die Ligandenfeldaufspaltung . Da für die Aufspaltung der d-Orbitale im elektrischen Feld der Liganden insgesamt keine Energie aufgewendet wird, müssen die beiden um je 2/5 energetisch abgesenkt und die drei um je 3/5 angehoben werden (Bild 5).
Die Ligandenfeldaufspaltung ist abhängig von der Ladung des Zentralteilchens und von der Art der Liganden. Es gibt Liganden, die ein starkes Ligandenfeld, d. h. eine große Aufspaltung erzeugen und solche, bei denen die Aufspaltung nur gering ist
Die Reihung der Liganden mit steigender Ligandenfeldstärke wird als spektrochemische Reihe bezeichnet.
Die d-Niveaus im oktaedrischen Ligandenfeld werden nun entsprechend dem PAULI-Prinzip und der hundschen Regel mit Elektronen besetzt. Sind drei d-Elektronen vorhanden, werden also die drei niedriger gelegenen mit je einem Elektron besetzt.
Kommt ein viertes Elektron hinzu, so ergeben sich zwei Möglichkeiten, abhängig von der Größe der Ligandenfeldaufspaltung . Ist diese nur klein, ist es energetisch günstiger, zunächst eines der beiden zu besetzen als die Spinpaarungsenergie aufzuwenden, die zur doppelten Besetzung eines Orbitals nötig wäre. In diesem Fall entsteht ein Komplex mit vier ungepaarten Elektronen.
Ist in einem starken Ligandenfeld hoch, so wird dagegen das vierte Elektron unter Spinpaarung in eines der entarteten eingeordnet. Es liegen zwei ungepaarte Elektronen vor.
Diese unterschiedliche Besetzung kann durch magnetische Messungen festgestellt werden. Im ersten Fall wird ein Paramagnetismus von 4 Bohr-Magnetonen ermittelt, was vier ungepaarten Elektronen entspricht. Im zweiten Fall beträgt der Paramagnetismus 2 Bohr-Magnetonen, d. h. es sind zwei ungepaarte Elektronen vorhanden.
Bei 4-7 Elektronen in den d-Niveaus der Metallionen können je nach der Stärke D des Ligandenfeldes Komplexe mit einer unterschiedlichen Anzahl von ungepaarten Elektronen entstehen.
Komplexe, die über eine größtmögliche Zahl von ungepaarten Elektronen verfügen, werden high-spin-Komplexe genannt.
Liegt die Elektronenkonfiguration mit der geringstmöglichen Zahl von ungepaarten Elektronen vor, so werden die entsprechenden Komplexe low-spin-Komplexe genannt.
-
Die unterschiedlich starke Annäherung der Liganden an die d-Orbitale des Metall-Ions führt zur Aufspaltung der d-Energieniveaus im oktaedrischen Ligandenfeld.
-
Die unterschiedlich starke Annäherung der Liganden an die d-Orbitale des Metall-Ions führt zur Aufspaltung der d-Energieniveaus im oktaedrischen Ligandenfeld.
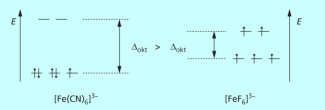
Früher wurden die high-spin-Komplexe wie FeF6 3- mit einem magnetischen Moment von fünf ungepaarten Elektronen als „magnetisch normal“ bezeichnet, weil sie die gleiche Zahl ungepaarter Elektronen hatten wie das „freie“ nicht komplexierte Ion. Der low-spin-Komplex [Fe(CN)6]3- mit nur einem ungepaarten Elektron wurde daher als magnetisch anormal bezeichnet.
Bei Eisen(II)-Komplexen (d 6) ist der Hexaquokomplex ein paramagnetischer high-spin-Komplex mit vier ungepaarten Elektronen, der Komplex [Fe(CN)6]4- ist ein low-spin-Komplex. Er ist diamagnetisch, alle Elektronen sind gepaart.
Diamagnetische Komplexe sind daher nur bei Ionen mit 6 d-Elektronen im low-spin-Fall wie [Fe(CN)6]4- oder [Co(NH3)6]3+ oder von Ionen mit 10 d-Elektronen wie [Zn(H2O)6]2+, [Ag(CN)2]- oder [Cu(CN)4]3- möglich.
-
Elektronenkonfigurationen von Eisen(III)-Komplexen
-
Elektronenkonfiguration des Hexaaquoeisen(II)-Ions