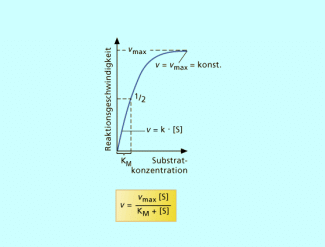
Michaelis-Konstante
Die Michaelis-Menten-Gleichung beschreibt die Abhängigkeit der Geschwindigkeit einer enzymkatalysierten Reaktion von der Substratkonzentration. Sie ist nach dem deutsch-amerikanischen Chemiker LEONOR MICHAELIS (1875-1949) benannt.
Die Michaeliskonstante charakterisiert die Affinität des Enzyms zu seinem Substrat. Sie entspricht derjenigen Substratkonzentration, bei der die Hälfte der maximalen Reaktionsgeschwindigkeit erreicht ist. ‚Misst man bei vorgegebener konstanter Enzymmenge die Geschwindigkeit der Reaktion in Abhängigkeit von der Substratkonzentration, so beobachtet man häufig einen Kurvenverlauf, aus dem man u.a. die Substratkonzentration KM , bei der die Halbsättigung des Enzyms erreicht ist, ablesen kann. KM-Werte sind dementsprechend ein Maß für die Bindungsstärke zwischen Enzym und Substrat.
Die Michaelis-Menten-Gleichung beschreibt die Abhängigkeit der Geschwindikeit einer enzymatischen Reaktion von der Konzentration des umzusetzenden Substrats. Die Substratkonzentration, bei der die Reasktionsgeschwindigkeit v die Hälfte der Maximalgeschwindigkeit Vmax erreict hat, wird als Michaliskonstante bezeichnet.
Bei niedrigen Substratkonzentrationen kann die Reaktionsgeschwindigkeit durch Erhöhung der Konzentration des Substrates gesteigert werden, da nicht alle Enzymmoleküle mit Substratmolekülen besetzt sind. Eine höhere Konzentration des Substrates steigert dann den gesamten Umsatz durch bessere Ausnutzung der Enzymmoleküle.
Bei hohen Substratkonzentrationen sind alle Enzymmoleküle besetzt; Sättigung ist erreicht.
-
Prinzip einer Enzymreaktion (schematisch vereinfacht)
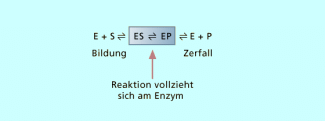
Die Enzym-Substrat-Zerfallsrate begrenzt die Reaktionsgeschwindigkeit. Sie kann auch durch weitere Erhöhung der Substratkonzentration nicht mehr gesteigert werden. Der Maximalwert ist erreicht. Höhere Reaktionsgeschwindigkeiten würden nur durch weitere Enzymzugabe erreicht werden.
Unter physiologischen Bedingungen ist eine geringe Substratkonzentration bedeutsam. Als Kenngröße für Enzyme wird die Konzentration angenommen, die die halbe Maximalgeschwindigkeit erzielt. Sie wird als Michaelis-Konstante bezeichnet. Ihr Wert ist (mol/l). Die -Werte der Enzyme liegen zwischen und mol/l.
Enzymaktivität bei unterschiedlichen Substratkonzentrationen
| -Werte einiger Enzyme | ||
| Enzym | Substrat | -Wert (mol/l) |
| Katalase | ||
| Hexokinase | Glucose | |
| Lysozym | Acetylglucosamin | |
| Glutamat-Dehydrogenase | Glutamat | |
Inzwischen sind auch die Wechselzahlen vieler Enzyme bekannt. Sie geben an, wie viele Substratmoleküle ein Enzymmolekül in einer Sekunde umsetzt.
| Wechselzahlen einiger Enzyme | |
| Enzym | max. Wechselzahl (Anzahl/s) |
| Acetylcholinesterase | 25 000 |
| Lactatdehydrogenase | 1 000 |
| Chymotrypsin | 100 |
| DNA-Polymerase | 15 |
-
Grafische Darstellung der Michaeliskonstante