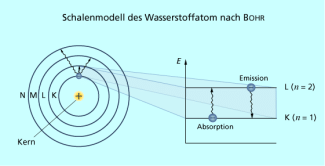
Das Atommodell von Niels Bohr
Auf der Grundlage des Atommodells von ERNEST RUTHERFORD (1871-1937) entwickelte NIELS BOHR (1885-1962) ein Schalenmodell, mit dem der Widerspruch zwischen der klassischen Physik und der Quantentheorie durch Postulate ausgeglichen werden sollte. Die Leistungsfähigkeit des Modells zeigte sich bei der quantitativen Interpretation der Spektren des Wasserstoffatoms, seine Grenzen jedoch bei der Deutung von Spektren von Atomen mit mehreren Elektronen. Das bohrsche Atommodell wurde daraufhin von ARNOLD SOMMERFELD (1868-1951) verfeinert und somit auch für Mehrelektronensysteme anwendbar.
Mit diesem einfachen Atommodell nach BOHR und SOMMERFELD können Elektronenkonfigurationen aufgestellt und viele Zusammenhänge zwischen der Struktur der Elektronenhülle und den Eigenschaften der Elemente im Periodensystem hergestellt werden. Es steht jedoch im Widerspruch zu den Gesetzen der klassischen Physik und kann auch nicht zur Erklärung der Atombindung herangezogen werden.
Die Frage nach der inneren Struktur der Materie beschäftigte die Menschen schon seit der Antike als griechische Naturphilosophen den Begriff Atom für kleinste, unteilbare Teilchen, aus denen die Materie aufgebaut ist, schufen. Dieses Atommodell wurde erst im 19. Jh. von JOHN DALTON (1766-1844) weiterentwickelt. DALTON schlussfolgerte aus experimentellen Untersuchungen, dass Atome kleine elastische, massegefüllte, ungeladene Kugeln sind, die bei chemischen Reaktionen weder gebildet noch zerstört, sondern nur neu miteinander kombiniert werden können.
Mit immer leistungsfähigeren wissenschaftlichen Methoden wurde die innere Struktur der Atome weiter untersucht. Auf der Basis seines berühmten Streuversuchs formulierte E. RUTHERFORD 1911 das nach ihm benannte Planetenmodell. Dieses enthält erstmals die Aussage, dass die Masse des Atoms überwiegend im Atomkern lokalisiert ist und dass die negativen Elektronen um den positiven Kern kreisen. Nach den Gesetzen der klassischen Physik dürften Atome aber nicht stabil sein, da sich positive und negative Teilchen anziehen und die Elektronen deshalb eigentlich in den positiv geladenen Atomkern stürzen müssten. Außerdem hatten die von J. J. BALMER gefundenen Linienspektren des Wasserstoffs gezeigt, dass die Atomhülle viel feiner strukturiert ist, als von RUTHERFORD angenommen.
-
Der dänische Physiker NIELS BOHR (1885-1962) entwickelte das Schalenmodell der Atome.

Zur Klärung dieser Widersprüche entwickelte der dänische Physiker NIELS BOHR ein neues, leistungsfähigeres Atommodell. Dabei nutzte er die ersten Erkenntnisse der modernen Quantenmechanik und formulierte sogenannte Postulate, in denen er annahm, dass die Gesetze der klassischen Physik im atomarem Bereich nicht gelten und durch andere Gesetze ersetzt werden müssen.
Die Grundidee war zunächst ein dynamisches Gleichgewicht zwischen der COULOMB-Kraft und der Zentrifugalkraft. Wenn die Elektronen auf stabilen Bahnen um den Kern kreisen, muss die Zentrifugalkraft genau gleich der Anziehungskraft des Elektrons durch die positive Kernladung sein. Aus der Gleichsetzung der Kräfte und der Berücksichtigung des Bahndrehimpulses der Elektronen konnte BOHR den Radius der Elektronenbahnen im Wasserstoffatom berechnen.
Für den Wert n = 1 ergibt sich daraus der Radius des Wasserstoffatoms im Grundzustand, der sogenannte bohrsche Atomradius, der sehr gut mit den experimentell für das Wasserstoffatom ermittelten Werten übereinstimmte.
-
Mathematische Ableitung der Berechnung des bohrschen Atomradius.

Im Jahr 1913 verknüpfte BOHR das rutherfordsche Atommodell mit der planckschen Hypothese der Energiequanten und der einsteinschen Lichtquantenvorstellung und formulierte seine berühmten Postulate, die die Grundlagen des nach ihm benannten Schalenmodells darstellen.
1. Postulat
Von allen theoretisch möglichen Elektronenbahnen werden einige diskrete Kreisbahnen (Schalen) als erlaubt angesehen, auf denen sich das Elektron bewegen kann, ohne zu strahlen.
2. Postulat
Wenn ein Elektron von einer Bahn zu einer anderen wechselt, wird Energie in Form von Lichtquanten (Photonen) abgegeben (Emission) oder aufgenommen (Absorption).
3. Postulat
Die erlaubten Bahnen entsprechen jeweils einem bestimmten Energieniveau des Elektrons. Wechselt ein Elektron die Bahn, so entspricht die abgegebene bzw. aufgenommene Energie der Energiedifferenz der Bahnen.
4. Postulat
Nur solche Bahnen sind im Atom stabil bei denen der Bahndrehimpuls des Elektrons ein ganzzahliges Vielfaches von ist.
Mit dem letzten Postulat führte BOHR die Zahl n zur Charakterisierung der Elektronenschalen K (n = 1), L (n = 2), M (n = 3), N (n = 4) usw. ein. Diese wurde später als Hauptquantenzahl bezeichnet und bestimmt hauptsächlich die Lage der Energieniveaus der Elektronen.
-
Mit dem Schalenmodell können die Linienspektren erklärt werden.
Mit dem bohrschen Schalenmodell (Simulation) konnte sowohl der Radius des Wasserstoffatoms berechnet werden als auch das Linienspektrum von Wasserstoff erklärt werden. Aber schon beim zweitschwersten Atom, dem Helium, wich der berechnete Atomradius deutlich von den experimentell ermitteltem Wert ab. Auch die Linienspektrum von Atomen mit mehreren Elektronen, z. B. der Alkalimetalle, waren komplizierter strukturiert und mit dem bohrschen Modell nicht exakt erklärbar.
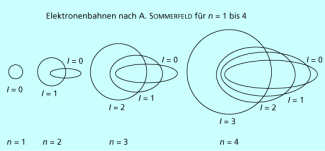
ARNOLD SOMMERFELD führte deshalb zur Interpretation eine weitere Bestimmungsgröße, die Nebenquantenzahl l ein. Er erklärte die bei Feinstruktur der Linienspektren durch das Auftreten von Ellipsenbahnen, wie sie in der Astronomie zu beobachten sind. Auf diesen Bahnen können Elektronen ebenfalls um den Atomkern „kreisen“. Die Ellipse ist durch ihre beiden Halbachsen definiert, so dass zwei Quantenzahlen, nämlich die Hauptquantenzahl n und die Nebenquantenzahl l zur Charakterisierung zur Verfügung standen. Daraus ergaben sich zu jedem Hauptenergieniveau mit n > 1 mehrere Unterniveaus bzw. Unterschalen (s-, p-, d-, f-Niveaus).
Jedes Hauptenergieniveau kann von maximal Elektronen besetzt werden, jedes Unterniveau von Elektronen. Diese Elektronenbesetzung der Schalen stimmt hervorragend mit dem Aufbau des Periodensystems der Elemente überein. Voll besetzte Schalen mit 2 (n = 1), 8 (n = 2) bzw. 18 (n = 3) Elektronen stellen stabile Elektronenkonfigurationen dar. Auf der Grundlage des Atommodells nach BOHR und SOMMERFELD können die Elektronenkonfigurationen aller Atome und Ionen unter Berücksichtigung der Unterniveaus formuliert werden. Dabei zeigt sich, dass alle Elemente in einer Hauptgruppe über die gleiche Valenzelektronenkonfiguration verfügen, woraus sich die weitgehend ähnlichen chemischen Eigenschaften ergeben.
Die Elemente in einer Periode haben dagegen die höchste besetzte Schale gemeinsam.
Die Vorstellungen von N. BOHR und A. SOMMERFELD wurden noch 1913 durch die Experimente von J. FRANCK und G. HERTZ bestätigt, die die Existenz der diskreten Energieniveaus in den Atomen bewiesen. Die Erkenntnisse von BOHR und SOMMERFELD konnten auch genutzt werden, um zu erklären warum Atome in Verbindungen danach streben, eine Achterschale (Oktettregel nach LEWIS) oder eine andere Valenzelektronenkonfiguration zu erreichen. Weiterführende Aussagen zur chemischen Bindung waren jedoch nicht möglich. Trotz seiner hohen Leistungsfähigkeit war das theoretische Gebäude dieses älteren quantenmechanischen Atommodells nicht konsistent, sondern war ein Spagat zwischen der klassischen Physik und der Quantentheorie, sodass die Theorie viele Kritiker hatte. Es wurde schon Ende der zwanziger Jahre durch das moderne quantenmechanische Atommodell abgelöst. Dieses Modell ist jedoch wesentlich komplizierter und weniger gut verständlich. Deshalb wird das sehr anschauliche Atommodell nach BOHR und SOMMERFELD auch heute noch für die Erklärung vieler Zusammenhänge genutzt:
Aussagen, Leistungen | Grenzen |
| Elektronen können sich nur auf bestimmten Bahnen (Schalen) aufhalten. Jeder dieser Bahnen entspricht ein diskretes Energieniveau. | Die Bewegung der negativen Elektronen um den positiven Kern widerspricht den Gesetzen der klassischen Physik. Die bohrschen Postulate müssen deshalb als willkürliche Annahmen gewertet werden. |
| Der Radius der Bahn des Wasserstoffelektrons (bohrscher Atomradius) kann berechnet werden. | Bei Mehrelektronensystemen stimmen berechnete Radien und experimentelle Werte nicht überein. |
| Die Spektren von Wasserstoffatomen sind quantitativ interpretierbar. Die Spektralserien des Wasserstoffes werden aus Naturkonstanten h, e und berechnet. | Spektren von Mehrelektronensystemen können erst durch die Verfeinerung nach SOMMERFELD qualitativ interpretiert werden. |
| Die Elektronenkonfigurationen aller Atome und Elektronen können aufgestellt und verglichen werden. | Es sind nur sehr begrenzte Aussagen zur chemischen Bindung möglich. |
| Änderungen des Baus der Elektronenhülle können mit periodischen Änderungen der Eigenschaften von Elementen in Beziehung gesetzt werden. Dabei ergibt sich ein direkter Zusammenhang zwischen dem Atombau und dem Periodensystem der Elemente. | Ab der 3. Periode des PSE entspricht die Anzahl der Elemente in einer Periode nicht mehr der maximalen Elektronenbesetzung der Schalen nach der Formel . |
Mit der Verbindung rutherfordscher Vorstellungen und erster quantenmechanischer Ideen (Planck, Einstein) wurde eine Brücke zwischen den Gesetzen der klassischen Physik und der Quantenphysik geschlagen. | Die Existenz diskreter Bahnen der Elektronen im Atom widerspricht den Erkenntnissen der Quantenphysik. |
-
Unterschiedliche Elektronenbahnen nach A. SOMMERFELD für n = 1 bis 4