Galvanische Elemente
Galvanische Quellen (Galvanische Zellen) sind Vorrichtungen die aus einer Anode (minuspol), einer Katode (Pluspol) und einem Elektrolyt bestehen und die auf der Grundlage elektrochemischer Reaktionen (Reduktions-Oxidations-Prozesse) elektrische Energie liefern. Damit ist die Nutzung elektrischer Energie unabhängig vom elektrischen Festnetz möglich.
Galvanische Elemente, benannt nach dem italienischen Mediziner LUIGI GALVANI, sind elektrochemische Zellen, in denen chemische Energie in elektrische Energie umgewandelt wird. Sie bestehen aus zwei miteinander kombinierten Elektroden.
Entwickelt wurden die ersten Formen dieser elektrischen Quellen von dem italienischen Physiker ALESSANDRO VOLTA (1745-1827).
Galvanische Elemente, bei denen durch nicht umkehrbare Reduktions-Oxidationsprozesse chemische Energie in elektrische Energie umgewandelt wird, werden auch als Primärzellen bezeichnet.
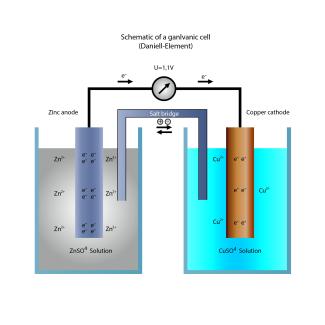
Daniell-Element
Das klassische Beispiel eines galvanischen Elements zur Energiegewinnung ist das Daniell-Element. Es wird aus einem Kupferblech, das in die wässrige Lösung eines Kupfer(II)-salzes taucht (linke Halbzelle Cu/Cu2+), und einem Zinkblech, das in die wässrige Lösung eines Zinksalzes taucht (rechte Halbzelle Zn/Zn2+), gebildet.
Kupfer-Ionen aus der Cu2+-Salzlösung scheiden sich am Kupferblech ab, während das unedlere Zink mit dem negativeren Standardpotenzial in der anderen Halbzelle in Lösung geht.
Katode: Cu2+(aq) + 2 e- Cu(s) Reduktion
Anode: Zn(s) Zn2+(aq) + 2 e- Oxidation
Gesamtzellreaktion: Zn(s) + Cu2+(aq) Zn2+(aq) + Cu(s)
Verwendet man jeweils 1 molare CuSO4- und ZnSO4-Lösungen, so beträgt die resultierende Zellspannung 1,11 V. Während der Stromentnahme ändern sich die Konzentrationen und die Zellspannung sinkt.
-
einfaches galvanisches Element
bilderzwerg - adobe stock
Leclanché-Element
Eine handelsübliche Monozelle bzw. Zink-Kohle-Batterie ist nach dem Prinzip des Leclanché-Elements aufgebaut. Die negative Anode wird durch einen äußeren Zinkbecker gebildet. Die Katode besteht aus einem Grafitstab, der von Braunstein (MnO2) umgeben ist. MnO2 bindet den im ersten Schritt entstandenen Wasserstoff und trägt durch diese Redoxreaktion zur Erhöhung der Zellspannung bei. Als Elektrolyt dient mit Stärke angedickte Ammoniumchlorid-Lösung. Deshalb bezeichnet man das Leclanché-Element auch als Trockenbaterie. Diese Primärzellen liefern eine Spannung von 1,5 V.
Katode (Grafitstift):
2 NH4 +(aq) + 2 e- + 2 Cl-(aq) 2 NH3(aq) + H2(g) + 2 Cl-(aq)
H2(g) + 2 MnO2(s) Mn2O3(s) + H2O(l)
Anode (Zinkmantel):
Zn(s) Zn+(aq) + 2 e-
Zn2+(aq) + 2 NH3(aq) + 2 Cl-(aq) [Zn(NH3)2]2+(aq) + 2 Cl-(aq)
Gesamtzellreaktion:
Zn(s) + 2 NH4 +(aq) + 2 MnO2(s) Mn2O3(s) + [Zn(NH3)2]2+(aq) + H2O(l)
-
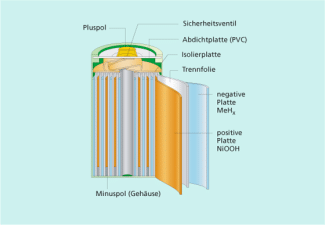
Aufbau eines Nickel-Metallhydrid-Akkumulators
Zink-Silberoxid-Batterien
Dieser Batterietyp findet als Knopfzelle in Taschenrechnern oder Armbanduhren Verwendung. Als Oxidationsmittel diente früher giftiges Quecksilberoxid, das aber inzwischen durch Silberoxid ersetzt wurde. An der Anode wird ähnlich wie beim Leclanché-Element Zink oxidiert. Als Elektrolyt verwendet man Kalilauge. Die Gesamtzellreaktion liefert eine Spannung von ca. 1,55 V.
Gesamtzellreaktion:
Zn(s) + Ag2O(s) ZnO(s) + 2 Ag(s)
Lithium-Zellen
Lithium-Zellen zeichnen sich durch eine lange Lebensdauer von bis zu 10 Jahren und eine hohe Zellspannung (E 0 [Li/Li+] = -3,04 V) aus. Als Anodenmaterial verwendet man Lithium-Mischoxide (LiNixCoyAl1-x-yO2 bzw. LiCoO2) und als Katodenmaterial Grafti/Mangandioxidelektroden oder polymermodifizierte Grafitelektroden. Da Lithium sehr heftig mit Wasser reagiert, werden organische Lösungsmittel oder Festelektrolyte eingesetzt. Lithiumzellen finden im Haushalt, der Computer- und Medizintechnik breite Anwendung. In Herzschrittmachern dient Lithiumiodid als Festelektrolyt, der die Katode (Iod eingebettet in ein leitfähiges Polymer) von der Anode trennt.
Gesamtzellreaktion: 2 Li(s) + I2(s) 2 LiI(s)
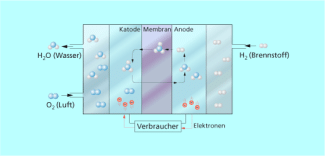
Brennstoffzellen
Ein Nachteil der Primärzellen besteht auch darin, dass die gespeicherte chemische Energie begrenzt ist. Diesen Nachteil haben Brennstoffzellen nicht, weil hier die Stoffe, aus denen die elektrische Energie gewonnen wird, kontinuierlich zu den Elektroden nachgeliefert werden.
Ein Beispiel ist die Umsetzung von Wasserstoff und Sauerstoff zu Wasser an katalytisch wirkenden Elektroden nach folgenden Teilprozessen.
Anode: 2 H2 + 4 OH- 4 H2O + 4 e-
Katode: 4 e- + O2 + 2 H2O 4 OH-
Brennstoffzellen arbeiten mit hohem Wirkungsgrad. Sie bieten zudem im Vergleich zu anderen Akkumulatoren prinzipiell günstigere Möglichkeiten, überschüssige Elektroenergie beispielsweise aus Windkraftwerken vorübergehend in Form von chemischer Energie (z. B. Elektrolyse von Wasser zu Wasserstoff und Sauerstoff) zu speichern und im Bedarfsfall zurückzugewinnen.
-
Aufbau einer Brennstoffzelle
Suche nach passenden Schlagwörtern
- Knopfzelle
- Batterie
- Volta-Element
- Leclanchè> Georges
- voltasche Säule
- Alessandro Volta
- elektrochemischen Spannungsreihe
- elektrochemische Zellen
- Stromquelle
- Alkali-Mangan-Element
- Flachbatterie
- galvanische Elemente
- Leclanché-Element
- Elektrode
- Elektrische Quelle
- Luigi Galvani
- Spannungsquelle
- Elektrolyt
- Elektrolyte

