Isomerie
Stoffe, deren Teilchen aus der gleichen Art und Anzahl von Atomen bestehen, können durchaus verschiedene Eigenschaften aufweisen. Bei gleicher Summenformel kann nämlich die Anordnung der Atome, die Struktur der sogenannten Isomere verschieden sein.
Man unterscheidet zwischen mehreren Formen der Isomerie, die nicht nur Auswirkungen auf physikalische Eigenschaften, sondern auch auf das chemische Reaktionsverhalten hat.
Der Begriff Isomerie
JUSTUS VON LIEBIG beschäftigte sich mit der Elementaranalyse von organischen Verbindungen und entwickelte daraus eine Routinemethode zur Bestimmung der quantitativen Zusammensetzung. Dabei stellte er 1823 fest, dass viele unterschiedliche Stoffe wie die Cyansäure (HOCN) und die Knallsäure (HCNO) gleiche Summenformeln aufweisen.
Diese Verbindungen haben aber trotz gleicher Summenformel unterschiedliche physikalische und chemische Eigenschaften. LIEBIG formulierte zur Veranschaulichung, dass aus gleichen Buchstaben ebenfalls unterschiedliche Worte gebildet werden können: „Dome - Mode - Odem“.
F. WÖHLER stellte 1828 aus Ammoniumcyanat Harnstoff her und synthetisierte damit eine organische Verbindung aus einer anorganischen Verbindung. Dass Harnstoff und Ammoniumcyanat Isomere sind, stellte er erst später fest.
Die Begriffe Isomerie und Isomere wurde 1830 von BERZELIUS in die Chemie eingeführt. Nach BERZELIUS sind isomere Stoffe, die „die gleichen Elementaratome, aber in ungleicher Weise zusammengelegt“ enthalten.
Heute versteht der Chemiker unter Isomeren Verbindungen gleicher Zusammensetzung bzw. Summenformel, die sich jedoch in der Anordnung der Atome, d. h. ihrer räumlichen Struktur unterscheiden. Daraus ergeben sich unterschiedliche Eigenschaften der Verbindungen (z.B. Siede- und Schmelztemperatur, chemische Reaktionsfähigkeit). Auch die Benennung der Stoffe ist unterschiedlich.
Es gibt verschiedene Arten der Isomerie :
Konstitutions- oder Strukturisomerie
Von Konstitutionsisomerie oder Strukturisomerie wird gesprochen, wenn Atome oder Atomgruppen unterschiedlich verknüpft sind.
Die einfachste Form ist die Bildung von Isomeren durch Verzweigung der Kohlenstoffketten. Die Zahl der möglichen Isomere mit einer Summenformel wächst mit der Zahl der Atome rasch an. Am Beispiel der Alkane wird dies deutlich.
Methan, Ethan und Propan besitzen keine Isomere. Butan mit der Summenformel kann dagegen zwei Isomere bilden:
![]()
Butan - 2-Methylpropan
(Siedetemperatur 0.5°C) - (Siedetemperatur -12°C)
Grundsätzlich gilt, dass verzweigte Verbindungen niedrigere Schmelz- und Siedetemperaturen aufweisen als unverzweigte. Das hängt vor allem mit der kleineren Oberfläche und den daraus resultierenden geringeren VAN-DER-WAALS-Kräften zusammen.
Pentan () besitzt drei Isomere, Hexan () bildet fünf und Heptan () schon neun verschiedene Konstitutionsisomere. Die Anzahl der möglichen isomeren Verbindungen wächst rasch an, z.B. bei dem Alkan
- mit 15 Kohlenstoffatomen auf 4347 Isomere
- mit 25 Kohlenstoffatomen auf 36797588 Isomere
- und mit 40 Kohlenstoffatomen gar auf 62491178805831 Isomere.
Eine andere Form der Konstitutionsisomerie besteht darin, dass beispielsweise funktionelle Gruppen im Molekül anders angeordnet sind.
Beispiel:
Propan-1-ol: Schmelztemperatur -126 °C, Siedetemperatur 97 °C
Propan-2-ol: Schmelztemperatur -88 °C, Siedetemperatur 82 °C
![]()
Außerdem gibt es auch die Möglichkeit, dass sich Mehrfachbindungen an unterschiedlichen Stellen im Molekül befinden.
Beispiel:
![]()
![]()
Stereoisomerie
Große Bedeutung in der Natur hat die Stereoisomerie. Dabei unterscheiden sich die Isomere durch die Anordnung der Atome im dreidimensionalen Raum, obwohl die Verknüpfung der Atome durch chemische Bindungen identisch ist.
Eine wichtige Form der Stereoisomerie ist die Spiegelbildisomerie. Diese kann bei Molekülen auftreten, bei denen an einem Kohlenstoffatom vier verschiedene Substituenten gebunden sind. Obwohl die Verknüpfung der Atome durch chemische Bindungen gleich ist, verhalten sich die beiden Isomere wie Bild und Spiegelbild.
Spiegelbildisomere der Milchsäure
![]()
Die Spiegelbildisomere (Enantiomere) unterscheiden sich nur geringfügig in ihren Eigenschaften, z. B. in ihrem optischen Drehwert. Milchsäure kann in einer L- Form (diese dreht polarisiertes Licht nach links) und in einer spiegelbildlich gleichen D- Form (diese dreht polarisiertes Licht nach rechts) vorkommen.
Verblüffend ist die unterschiedliche pharmakologische, toxische oder stoffwechselaktive Wirkung solcher Enantiomere. Alle auf der Erde lebenden Lebewesen enthalten nur L- Aminosäuren und können auch nur L- Formen von organischen Verbindungen verstoffwechseln. Diese seltsame Eigenschaft ist bis heute unerklärlich.
cis-, trans-Isomerie
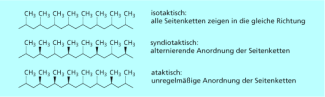
Die cis-, trans-Isomerie ist eine andere Form der Stereoisomerie, die auftritt, wenn an beiden Enden der C=C-Doppelbindung je zwei verschiedene Substituenten gebunden sind. Die größeren Substituenten können entgegengesetzt, trans-, oder auf einer Seite der Doppelbindung, cis-, angeordnet sein. Auch hier sind die Unterschiede in den Eigenschaften bei kleinen Molekülen gering. Bei Makromolekülen, d. h. in der Kunststoffchemie, ist jedoch die Anordnung der Substituenten von großer Bedeutung für die Eigenschaften, beispielsweise von Synthesekautschuk oder Polypropylen, die sogenannte Taktizität.
![]()
Es existieren noch eine Reihe weiterer Formen der Isomerie. Diese Erscheinung ist nicht nur auf organische Moleküle begrenzt. So findet man noch weitere Isomerieformen bei anorganischen Komplexverbindungen.
-
Taktizität von Makromolekülen