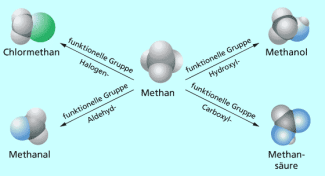
Überblick der funktionellen Gruppen
Viele Organische Moleküle enthalten neben den Elementen Kohlenstoff und Wasserstoff auch noch andere Elemente.
Am häufigsten sind dies Sauerstoff, Stickstoff und Schwefel sowie Halogene. Diese Elemente bestimmen maßgeblich die physikalischen und chemischen Eigenschaften der organischen Stoffe. Man bezeichnet sie als funktionelle Gruppen. Nach solchen strukturellen Merkmalen fasst man Stoffe zu Stoffgruppen zusammen.
Die Eigenschaften der Stoffe werden durch ihren Bau bestimmt. Bei organischen Stoffen spielen dabei die Art und Anzahl der Atome und ihre Anordnung im Molekül eine Rolle. Neben den Elementen Kohlenstoff und Wasserstoff enthalten viele organische Stoffe noch weitere Elemente, wie Sauerstoff und Stickstoff, Halogene (Fluor, Chlor, Brom, Iod) oder Schwefel. Diese Elemente besitzen eine von Wasserstoff und Kohlenstoff oft deutlich verschiedene Elektronegativität und beeinflussen so die Elektronenverteilung innerhalb der organischen Moleküle. Daraus resultieren u.a. inner- und zwischenmolekulare Kräfte, die entscheidend die physikalischen Eigenschaften der Stoffe, wie Schmelz- und Siedepunkte, Löslichkeiten in Wasser oder anderen Lösemitteln oder die Flüchtigkeit, prägen.
Atome der oben genannten Elemente bezeichnet der Organiker als Heteroatome. Atomgruppen, die Heteroatome enthalten, beeinflussen entscheidend die Eigenschaften und die "Funktion" des jeweiligen Stoffes und werden deshalb funktionelle Gruppen genannt.
Die Stärke des Einflusses dieser funktionellen Gruppen hängt aber auch von der Länge und vom Aufbau des restlichen Teils des Moleküls ab. So nimmt beispielsweise der Einfluss einer funktionellen Gruppe bei kettenförmigen organischen Stoffen mit Zunahme der Kettenlänge ab. Dadurch kommt es auch innerhalb von homologen Reihen zu geringfügig abgestuften Eigenschaften.
Neben den physikalischen Eigenschaften der Stoffe werden durch die funktionellen Gruppen vor allem die chemischen Eigenschaften, d. h. ihre Reaktionsfähigkeiten und -möglichkeiten bestimmt. Durch chemische Reaktionen lassen sich funktionelle Gruppen gezielt ineinander umwandeln oder durch andere funktionelle Gruppen ersetzen. So kann man beispielsweise eine Carboxylgruppe (Carbonsäure) durch Reduktion in eine Hydroxygruppe (Alkanol bzw. Alkohol) überführen oder eine Hydroxygruppe (Alkanoll bzw. Alkohol) durch eine Aminogruppe (Amin) ersetzen. Auf diese Weise kann man gezielt in der organischen Synthese verschiedene Stoffe aufbauen und so u.a. neue Wirkstoffe für Medikamente oder Farbstoffe für Textilien herstellen.
In der Schule werden nur einige wenige funktionelle Gruppen an ausgewählten Beispielen behandelt. In der Übersicht werden nur die wichtigsten aufgeführt.
| Stoffklasse | Funktionelle Gruppe | Beispiel | |||
| Name | For- mel | Bezeichnung | Name und Strukturformel | verein- fachte Struktur- formel | |
| Alkohole | Hydroxygruppe | -OH | -ol | Ethanol (Ethylalkohol) | |
| Phenole | Hydroxygruppe | -OH | Hydroxy- | Hydroxybenzen (Phenol) | |
Halogen-kohlen-wasser-stoffe | Halogenid | -F -Cl -Br -I (Hal) | Halogen- | Monobrom- ethan (Ethylbromid) | |
| Amine | Aminogruppe | -amin | Ethylamin | ||
| Ether | Ethergruppe | -O- | -ether | Diethylether | |
| Aldehyde | Aldehydgruppe | -CHO | -al | Ethanal (Acet- aldehyd) | |
| Ketone | Ketogruppe | -on | Propan-2-on (Aceton) | ||
| Carbonsäure | Carboxygruppe | -COOH | -säure | Ethansäure (Essigsäure) | |
| Ester | Estergruppe | -ester | Ethansäure- methylester | ||
Der Einfluss der funktionellen Gruppen soll exemplarisch am Beispiel kettenförmiger Alkohole (Alkanole) gezeigt werden.
Die Hydroxygruppe ist eine polare Atomgruppe. Am Sauerstoffatom bildet sich ein negativer Ladungsschwerpunkt, am Kohlenstoffatom bzw. am Wasserstoffatom ein positiver Ladungsschwerpunkt. Diese Polarisierung ist entscheidend für die Eigenschaften der Stoffe.
Aufgrund der funktionellen Gruppe sind für diese Verbindungen einige chemische Reaktionen typisch.
Reaktion mit Alkalimetallen
Die Reaktion erfolgt unter Bildung von Alkoholaten und Wasserstoff und ist formal eine Redoxreaktion. Dabei wird das Alkalimetall oxidiert und Wasserstoffatome aus der Hydroxygruppe zu elementarem Wasserstoff reduziert.
Esterbildung
Alkohole reagieren u. a. mit Carbonsäuren unter Abspaltung von Wasser zu Carbonsäureestern.
Oxidationen
Aufgrund der funktionellen Gruppe lassen sich Alkohole oxidieren. Als Produkte entstehen bei der Oxidation primärer Alkohole im ersten Schritt Aldehyde und in einem weiteren Oxidationsschritt Carbonsäuren. Handelt es sich um sekundäre Alkohole, bilden sich als Oxidationsprodukte Ketone.
-
Ein organisches Molekül mit einem Kohlenstoffatom kann vier verschiedene funktionelle Gruppen tragen.