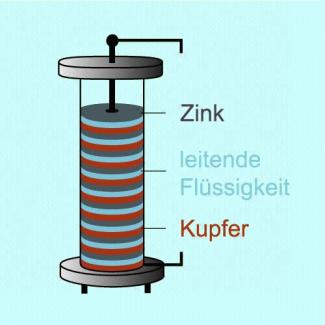
Volta-Element
Galvanische Elemente sind Vorrichtungen die auf der Grundlage von Reduktions-Oxidations-Reaktionen elektrische Energie liefern. In der praktischen Ausführung werden sie als Elemente bezeichnet, wobei mehrere Elemente zu Batterien zusammengeschlossen werden können.
Unterschieden wird zwischen primären Elementen, deren Strom liefernder chemischer Grundprozess z. Zt. technisch noch nicht umkehrbar ist (Taschenlampenbatterie) und den sekundären Elementen bei denen der Strom liefernde Vorgang umkehrbar (Laden / Entladen) ist (Bleiakkumulator). Ein Volta-Element ist die Grundform eines galvanischen Elementes, enwickelt von ALESSANDRO VOLTA. Es ist eine einfache elektrische Quelle, in der elektrische Energie gespeichert ist und die als Spannungsquelle zur Verfügung steht.
Die elektrische Spannung entsteht dadurch, dass zwei verschiedene Metalle in eine leitende Flüssigkeit gebracht werden. VOLTA selbst verwendete Zink und Kupfer.
Ein Volta-Element ist die Grundform einer Batterie. Es ist eine einfache elektrische Quelle, in der elektrische Energie gespeichert ist und die als Spannungsquelle zur Verfügung steht.
Die elektrische Spannung entsteht dadurch, dass zwei verschiedene Metalle in eine leitende Flüssigkeit gebracht werden. Dadurch werden elektrische Ladungen getrennt.
Das Volta-Element ist nach ALESSANDRO VOLTA (1745 - 1827) benannt. Er selbst verwendete Zink und Kupfer als Metalle und tauchte diese in Salzwasser.
-
VOLTA-Element
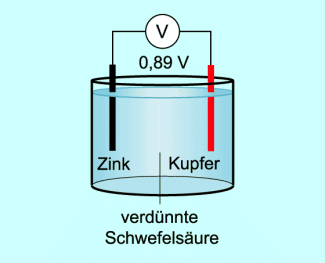
Man kann auch andere elektrisch leitende Flüssigkeiten verwenden, wie z.B. Lauge oder verdünnte Schwefelsäure.
VOLTA entdeckte das Prinzip dieser elektrischen Quelle 1794, nachdem er sich ausführlich mit der von LUIGI GALVANI 1791 veröffentlichten Beschreibung der „tierischen Elektrizität“ beschäftigt hatte.
Um eine größere Spannung zu erhalten, verband er mehrere Elemente so, wie das in Bild 3 dargestellt ist.
-
Tassenkrone von VOLTA

ilbusca - iStock
1830 schrieb er in einem Brief: „ ... Dreißig, vierzig ... oder mehr Kupferstücke, ... jedes in Verbindung mit einem Stück Zink; ferner eine gleiche Anzahl Schichten, z.B. Salzwasser, Lauge oder dergleichen; eine solche Anlage der Leiter stets in der gleichen Weise wiederholt; das ist alles, woraus mein neuer Apparat besteht.“
Eine solche Anordnung von in Reihe geschalteten Volta-Elementen bezeichnet man als voltasche Säule.
Bei einer solchen voltaschen Säule addieren sich die Spannungen der einzelnen Elemente zu einer Gesamtspannung.
Das Prinzip des Volta-Elements wird noch heute in Monozellen, Batterien und Akkumulatoren genutzt.
-
Voltasche Säule zur Erzeugung größerer Spannung