Energie bei chemischen Reaktionen
Jede chemische Reaktion ist mit energetischen Prozessen verbunden. Für die Auslösung chemischer Reaktionen ist meist eine Aktivierungsenergie erforderlich. Bei chemischen Reaktionen selbst erfolgen mit den Stoffumwandlungen häufig auch Energieumwandlungen. Dabei wird zwischen exothermen und endothermen Reaktionen unterschieden.
Jede chemische Reaktion ist mit Energieumwandlungen verbunden. So wird z. B. beim Verbrennen von Holz die im Holz gespeicherte chemische Energie in thermische Energie und Lichtenergie umgewandelt, die in Form von Wärme und Licht an die Umgebung abgegeben werden. Zugleich sind chemische Reaktionen auch mit Stoffumwandlungen verbunden. Aus dem Holz entsteht Asche. Die Verbrennung erfolgt unter Verbrauch von Sauerstoff, wobei Kohlenstoffdioxid entsteht.
Aktivierungsenergie
Viele chemische Reaktionen laufen nicht von selbst ab. So bildet sich z. B aus Wasser nicht von allein Wasserstoff und Sauerstoff. Eine Kerze beginnt nicht von allein zu brennen. Die Fotosynthese in Pflanzen erfolgt nur, wenn Sonnenlicht einfällt und damit Energie zugeführt wird.
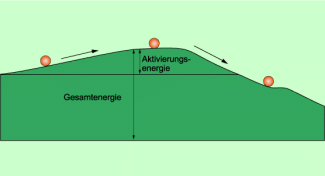
Die Energie, die erforderlich ist, um eine chemische Reaktion in Gang zu setzen, wird als Aktivierungsenergie bezeichnet.
Wie groß diese Energie ist, hängt von den Reaktionspartnern und den gegebenen Bedingungen ab.
Vergleichbar ist das mit der Bewegung einer Kugel über einen Berg hinweg: Damit sie sich auf den Berg hinauf bewegt, muss ihr Energie zugeführt werden (Aktivierungsenergie). Dann rollt sie allein den Berg hinab und gibt dabei Energie ab.
-
Aktivierungsenergie kann mit der mechanischen Energie einer Kugel verglichen werden.
Exotherme chemische Reaktionen
Stoffumwandlungen, bei denen thermische Energie in Form von Wärme abgegeben wird, nennt man exotherme chemische Reaktionen. Es wird dabei Energie freigesetzt, die z. B. genutzt werden kann, um Wärme und Licht abzugeben oder um mechanische Arbeit zu verrichten.
Typische exotherme Reaktionen sind z. B. das Verbrennen von Benzin im Zylinder eines Motors oder das Verbrennen von Kohle in einem Ofen. Für alle diese Reaktionen gilt: Die in den Ausgangsstoffen gespeicherte Energie ist größer als die in den Reaktionsprodukten enthaltene Energie. Diese Energiedifferenz wird auch als Reaktionswärme bezeichnet.
Endotherme chemische Reaktionen
Stoffumwandlungen, die nur erfolgen, wenn Energie in Form von Wärme zugeführt wird, nennt man endotherme chemische Reaktionen.
Ein Beispiel für eine solche endotherme Reaktion ist die Entstehung von Stickstoffmonooxid aus Stickstoff und Sauerstoff. Diese Reaktion "verbraucht" Wärme. Für alle endothermen Reaktionen gilt: Die in den Reaktionsprodukten enthaltene Energie ist größer als die in den Ausgangsstoffen vorhandene Energie.

