Anomalie des Wassers
Wasser ist das am häufigsten vorkommende Oxid, das in der Natur in allen drei Aggregatzuständen anzutreffen ist. Zur Wasserhülle der Erde gehört das Wasser der Meere, das Wasser auf den Landflächen in Seen, Mooren, Flüssen, Teichen usw., das Wasser innerhalb der Lufthülle (Atmosphäre) und auch das Wasser innerhalb der Gesteinshülle (Lithosphäre). Das Gesamtwasservolumen wird auf 1,454 km3 geschätzt. Nur 2,47 % davon sind Süßwasser. Das Wasser auf unserer Erde befindet sich in einem Kreislauf.
Es ist Lebensraum für viele Organismen und Lösungsmittel für eine Vielzahl von Verbindungen wie Säuren, Basen oder Salze. Deshalb fungiert Wasser als Transportmittel in der Natur, aber auch selbst als Ausgangsstoff für eine Vielzahl chemischer Reaktionen, z. B. die Fotosynthese.
Aufgrund seiner chemischen Bindungsverhältnisse weist Wasser einige außergewöhnliche Eigenschaften auf, die man als Anomalie des Wassers bezeichnet.
Wasser ist für das Leben auf der Erde von großer Bedeutung. Es ist Lebensraum für viele unterschiedliche Organismen sowohl im Meerwasser als auch im Süßwasser.
Wasser ist ein gutes Lösungsmittel sowohl für Salze als auch für viele andere Stoffe. Das ist sehr wichtig für das Leben auf der Erde. Beispielsweise liegen die Nährsalze im Boden in Ionen, also in gelöster Form vor. Nur in dieser Form können die Pflanzen die Stoffe über die Wurzel aus dem Boden aufnehmen.
Wasser hat einen großen Anteil an unserem Blut. Da sich viele Stoffe in ihm lösen, ist es auch als Transportmittel innerhalb des Körpers gut geeignet. Auch in Flüssen und Bächen werden viele Stoffe transportiert.
Ohne Wasser können viele pflanzliche Samen nicht quellen (Quellungsmittel). Die Quellungsvorgänge bilden aber die Voraussetzung für das Keimen der Samen.
Wasser bildet einen wesentlichen Ausgangsstoff für chemische und biochemische Reaktionen, z. B. für die Fotosynthese.
Viele biochemische Reaktionen können nur im Wasser stattfinden. Es ist also Reaktionsraum. Daher besteht unser Körper zu einem großen Teil aus Wasser und ein starker Wasserverlust wird lebensbedrohlich.
Die Bedeutung des Wassers für das Leben auf der Erde hat ihre Ursache in den Eigenschaften von Wasser.
Einige dieser Eigenschaften sind außergewöhnlich und werden unter dem Stichwort Anomalie des Wassers zusammengefasst.
Dichte
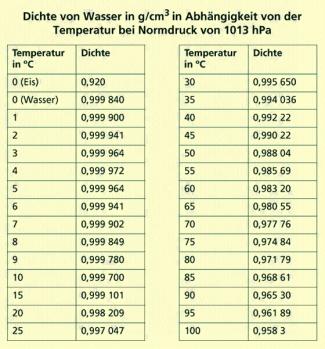
Durch genaue Messungen kann man die Abhängigkeit der Dichte des Wassers von der Temperatur ermitteln. Wasser weist eine Dichteanomalie auf. Es hat bei 4 °C sein kleinstes Volumen und damit seine größte Dichte. Wird es im Herbst kalt, sinkt z. B. das an der Oberfläche abgekühlte Wasser nach unten und das auf 0 °C abgekühlte Wasser erstarrt an der Oberfläche. Während Wasser von 0 °C eine Dichte von etwa 1 g/cm3 hat, beträgt die Dichte von Eis bei 0 °C etwa 0,92 g/cm3. Deshalb schwimmt Eis auf Wasser. Das Verhältnis der Dichten von Eis und Wasser ist auch der Grund dafür, dass sich bei einem Eisberg etwa 9/10 unter Wasser und nur etwa 1/10 über Wasser befindet. Das macht sie so gefährlich.
Schmelzpunkt
Ein Stahldraht, welcher über einen Eisblock gelegt und mit einem Gewicht beschwert wird, zerteilt den Eisblock mit der Zeit.
Denselben Effekt nutzen wir, wenn wir auf Kufen über das Eis gleiten. Vielleicht hat sich jeder schon einmal gefragt, warum man auf einer glatten Betonfläche nicht Schlittschuh laufen kann, sondern immer eine Eisbahn benötigt wird. Durch das Körpergewicht wird über die schmale Kufe Druck auf das Eis ausgeübt. Die Ursache ist die Erniedrigung des Schmelzpunkts bei Druck. Das Eis schmilzt an der Oberfläche und bildet einen Gleitfilm. (Zum Teil spielt auch die beim Gleiten auf dem Eis erzeugte Reibungswärme eine Rolle.)
-
Dichte von Wasser bei unterschiedlichen Temperaturen
Volumen
Wasser dehnt sich im Gegensatz zu anderen Stoffen beim Gefrieren aus. Es kommt zu einer Volumenzunahme um 9 %.
Füllt man z. B. eine Stahlkugel mit Wasser, verschraubt sie fest und gibt sie anschließend in ein Kältebad, führt das zu einer erschreckenden Explosion des Stahlkörpers. Gewaltige Kräfte wirken! Dies ist vergleichbar mit der im Tiefkühlfach vergessenen Sektflasche, die ebenfalls explodiert.
Der Effekt spielt in der Natur eine große Rolle. Als Sonderform der Temperaturverwitterung gilt die Frost(sprengungs)verwitterung. Hier wird die Gesteinsbeanspruchung durch das häufige Auftauen und Wiedergefrieren des sich in den Hohlräumen des Gesteins befindlichen Wassers verursacht. Dadurch wird der Zerfall des Gesteins stark beschleunigt. In Gebieten mit tageszeitlichem Frostwechsel, beispielsweise in den subpolaren Gebieten der Erde und in den Hochgebirgen, ist diese Verwitterungsform für die Gestaltung des Reliefs besonders bedeutsam.
Die Ausdehnung von Wasser bei Abkühlung und insbesondere bei Eisbildung muss auch im Alltag beachtet werden. Die Asphaltschäden, die nach dem Winter sichtbar werden und jährlich Millionen kosten, gehen ebenfalls auf diese Frostverwitterung zurück. Frieren z. B. frei liegende Wasserrohre oder Pumpen ein und befindet sich Wasser in ihnen, so dehnt sich dieses Wasser bei der Bildung von Eis aus und kann die Rohre bzw. Pumpen regelrecht auseinandersprengen. Deshalb ist es auch erforderlich, dem Kühlwasser von Pkws Frostschutzmittel beizugeben, weil ansonsten die Möglichkeit besteht, dass die Kühlflüssigkeit einfriert und den Kühler sprengt.
Aggregatzustand
Wasser gefriert bei 0 °C und geht erst bei 100 °C in den gasförmigen Aggregatzustand über. Bei Normalbedingungen ist Wasser flüssig. Da sich das Leben im Wasser entwickelt hat, hat auch dieser Fakt große Bedeutung für das Leben auf der Erde. Der flüssige Aggragatzustand von Wasser ist ebenfalls etwas Besonderes. Alle Wasserstoffverbindungen von Elementen, die im Periodensystem der Elemente (PSE) dem Sauerstoff benachbart sind (wie Chlorwasserstoff, Ammoniak, Schwefelwasserstoff), sind gasförmig.
Spezifische Wärmekapazität
Nicht zuletzt ist die Verdampfungswärme von Wasser und seine spezifische Wärmekapazität viel größer als bei anderen Stoffen. Ersteres spielt bei der Temperaturregulation unseres Körpers eine Rolle, im Zuge derer der Körper sich durch Schwitzen vor Überhitzung schützt. Letzteres ist sogar für die „Temperaturregelung“ unseres Planeten wesentlich: Große Meeresströmungen, z. B. der Golfstrom, beeinflussen das Klima in vielen Ländern. So transportiert z. B. der Golfstrom warmes Wasser und damit Wärme aus dem mittelamerikanischen Bereich (Karibik) quer über den Atlantik bis zu den Küsten Irlands, Englands, Schottlands, Norwegens und Russlands. Folgen davon sind beispielsweise, dass an der Westküste Englands Palmen wachsen und die norwegische Westküste stets eisfrei bleibt. Das gilt selbst für einen so weit nördlich gelegenen Hafen wie Murmansk in Russland.
Bau des Wassermoleküls
Die Ursache für dieses Verhalten ist in der Molekülstruktur des Stoffs, in den Kräften, die zwischen den Molekülen wirken, und in der sich daraus ableitenden räumlichen Anordnung der Teilchen bei verschiedenen Temperaturen zu finden.
Wassermoleküle bestehen jeweils aus einem Sauerstoffatom und zwei Wasserstoffatomen. Die beiden nicht bindenden Elektronenpaare des Sauerstoffatoms führen zu einer Deformation des Tetraederwinkels (ideal 109,5°) zwischen den Wasserstoffatomen und dem eingeschlossenen Sauerstoffatom. Der Winkel beträgt daher im Wassermolekül 104,5°.
Des Weiteren bewirkt das Sauerstoffatom (hoher EN-Wert), dass die herausgebildeten Elektronenpaarbindungen zu den Wasserstoffatomen stark polarisiert werden. Die Elektronendichte am Sauerstoffatom wird stark erhöht, an den Wasserstoffatomen stark verringert.
Durch die oben beschriebene Winkelung und die darunter aufgezeigte Polarisierung zeigt das Wassermolekül alle Eigenschaften eines Dipols.
Unter 0 °C bilden Wassermoleküle ein Molekülgitter. In ihm ist jedes Sauerstoffatom tetraedrisch von vier Wasserstoffatomen umgeben. Zu den „eigenen“ Wasserstoffatomen existieren zwei polarisierte Atombindungen und zu den beiden anderen Wasserstoffatomen, die von benachbarten Wassermolekülen stammen, werden Wasserstoffbrückenbindungen ausgebildet.
![]()
Diese Anordnung ergibt ein weitmaschiges Gitter mit durchgängigen sechseckigen Hohlräumen. Die Dichte des so entstehenden Stoffs Eis ist geringer als die des flüssigen Wassers. Eis schwimmt oben.
Es ist in reiner Form farblos, erscheint jedoch oft bläulich bis leicht grünlich. Dies ist darauf zurückzuführen, dass Eis sehr leicht Einschlussverbindungen (Clathrate) bildet. Dabei lagern sich Moleküle gasförmiger Stoffe in das Gitter der Wassermoleküle ein. Diese Tatsache nutzt man zur Bestimmung der Zusammensetzung der Atmosphäre in frühen Erdzeiten. Man nimmt dazu Bohrungen in große Tiefen im Dauereis des Nordpols vor. Beim langsamen, gezielten Auftauen werden die dabei eingeschlossenen Gase freigesetzt und deren Zusammensetzung bestimmt. Diese entspricht der Zusammensetzung der Atmosphäre zu früheren Zeiten.
Die Struktur von Eis ist durch 12 unterschiedliche Kristallgitter und 2 amorphe Modifikationen gekennzeichnet. Damit sind von festem Wasser (Eis) mehr Zustände bekannt als von jeder anderen festen Substanz. Eis entsteht durch Gefrieren von Wasser. Dabei können sich Hagel, Reif, Blockeis oder Schnee, mit oft charakteristischen Kristallformen (Schneeflocken) bilden. Wer schon einmal Ski gelaufen ist weiß, dass es viele verschiedene Formen von Schnee gibt. Die Inuit (Eskimos) kennen deshalb viele verschiedene Worte für Wasser in gefrorenem Zustand. Die Erkennung der unterschiedlichen Schneestrukturen sichert ihnen das Überleben in dieser rauen Umgebung. In der Schweiz gibt es Wissenschaftler, die sich mit der Strukturveränderung beim Schnee befassen, um dann Aussagen über mögliche Lawinengefahren machen zu können.
Bei einer Temperaturerhöhung über 0 °C beginnt das Eis zu schmelzen, zerbricht das Gitter teilweise. Einzelne Wasserstoffbrückenbindungen werden gelöst.
Doch auch in flüssigem Wasser sind Teile der ursprünglichen Gitterstruktur nachweisbar. Man nennt diese Cluster.
Da sich im flüssigen Zustand freibewegliche Wassermoleküle in noch vorhandene Gitterstrukturen einlagern, nimmt die Dichte zu und erreicht erst bei 4 °C den größten Wert. 1cm3 Wasser wiegt dann 1 g.
Bei weiterer Temperaturerhöhung nimmt wie bei allen anderen Flüssigkeiten die Bewegungsenergie der Moleküle zu, die Abstände der Teilchen zueinander vergrößern sich, die Dichte des Stoffs verringert sich weiter; bei 100 °C geht das Wasser in den gasförmigen Aggregatzustand über.
Bedeutung der Anomalie des Wassers
Die Anomalie des Wassers ist für das Leben von Tieren und Pflanzen im Wasser sehr wichtig und ermöglichst dieses Leben erst. Dazu betrachten wir die Verhältnisse in einem See zu verschiedenen Jahreszeiten.
Im Sommer wird das Wasser von der Sonne erwärmt. Das leichtere, wärmere Wasser bleibt an der Oberfläche und wird durch Wind in den oberen Schichten vermischt. Tiefer liegende Schichten sind kühler. Es bildet sich eine charakteristische Temperaturschichtung heraus.
Diese Temperaturschichtung des Wassers kann man z. B. beim Baden feststellen. Je größer die Tiefe ist, umso niedriger wird die Temperatur des Wassers.
Im Herbst ist die Sonneneinstrahlung geringer. Auch die Luft ist kühler. Das Wasser kühlt sich allmählich ab. Durch Strömungen erfolgt eine Durchmischung des Wassers und damit auch ein Temperaturausgleich.
Im Winter schwimmt Eis auf flüssigem Wasser, obwohl sonst alle festen Stoffe in ihren Schmelzen untergehen. Die Bilder schwimmender Eisberge im Polarmeer sind jedem bekannt und nicht erst seit dem Untergang der Titanic auch als Gefahr erkannt. Trotzdem hat diese sonderbare Eigenschaft Bedeutung für das Überleben von Wasserorganismen im Winter. Die Gewässer frieren niemals von unten nach oben zu, sondern immer von oben nach unten. Hat das Gewässer eine bestimmte Tiefe, so bildet sich am Gewässergrund eine Wasserschicht, die eine konstante Temperatur von 4 °C hat.
Im Frühjahr nimmt die Sonneneinstrahlung wieder zu. Es kommt zu einer allmählichen Erwärmung, zu einer Durchmischung des Wassers und damit zu einem Temperaturausgleich.

