Indikatoren für den pH-Wert und ihre Wirkungsweise
Säuren und Basen gehören zu den am weitesten verbreiteten chemischen Substanzen. Zur Bestimmung der Konzentration von Säuren und Basen z. B. durch Titration werden sogenannte Indikatoren (Anzeiger) verwendet. Farbindikatoren für Säure-Base-Reaktionen sind schwache organische Säuren oder Basen, die je nach dem pH-Wert der Lösung eine unterschiedliche Struktur und damit verschiedene Farben aufweisen. Anhand der Farbänderung kann man den pH-Wert einer Lösung oder den Äquivalenzpunkt einer Titration bestimmen.
Säure-Base-Reaktionen
Säuren und Basen gehören zu den am weitesten verbreiteten chemischen Substanzen, die sowohl im Alltag (saure Speisen, alkalische Seifenlösungen, Reinigungsmittel) als auch in Natur und Technik (saurer Regen, Mineralsäuren wie Schwefelsäure und Salpetersäure, Magensaft) eine große Bedeutung haben.
Eine der wichtigsten Größen im Zusammenhang mit Säuren und Basen ist der pH-Wert . Er ist ein Maß für die Konzentration der Wasserstoff-Ionen (bzw. Hydronium-Ionen) in einer Lösung.
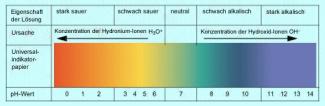
Ist der pH-Wert < 7, so reagiert die Lösung sauer, liegt er dagegen im Bereich > 7, so spricht man von einer alkalischen oder basischen Lösung. Neutrale Lösungen sind Lösungen deren pH-Wert bei 7 liegt.
Um den pH-Wert einer Lösung zu bestimmen, kann man mit speziellen Messgeräten (pH-Meter, Potenziometer) arbeiten. Eine andere Möglichkeit besteht darin, der Lösung einen in Wasser löslichen Farbstoff zuzusetzen, dessen Farbe sich in Abhängigkeit vom pH-Wert der Lösung ändert.
Säure-Base-Indikatoren und ihre Wirkungsweise
Solche Farbstoffe nennt man Indikatoren (lat.: indicare = anzeigen). Am verbreitetsten sind in der Chemie die Säure-Base-Indikatoren, die nicht nur zur Anzeige des pH-Werts, sondern auch zur Bestimmung des sogenannten Äquivalenzpunkts von Säure-Base-Titrationen genutzt werden. Der Ablauf solcher Titrationen zur quantitativen Bestimmung des Säure- oder Basengehalts einer Lösung ist in einem anderen Beitrag auf dieser CD erläutert.
Die bei den Säure-Base-Titrationen genutzten Indikatoren sind selbst schwache organische Säuren bzw. Basen, die aber bei unterschiedlicher Hydronium-Ionenkonzentration ihre Farbe ändern. Der Farbumschlag beruht darauf, dass durch den Protonenaustausch Strukturänderungen der Verbindungen auftreten, die zu einer Farbänderung des Stoffes führen.
In der folgenden allgemeinen Beispielgleichung steht in der Formel „IndH“ Ind für den Indikator. Das H macht deutlich, dass es sich um eine Säure handelt.
Die unterschiedlich farbigen Indikatorsäure und die Indikatorbase liegen in einem chemischen Gleichgewicht vor. In basischer Umgebung gibt die Indikatorsäure IndH ein Proton ab. Dadurch entsteht das negativ geladene Ion des Indikators und bestimmt die Farbe der Lösung. Im sauren pH-Bereich wird das Proton wieder aufgenommen, und die Lösung weist die durch die Indikatorsäure bestimmte Färbung auf.
Der Farbwechsel erfolgt nicht sprunghaft, sondern je nach dem Konzentrationsverhältnis von Indikatorsäure und Indikatorbase in einem bestimmten pH-Bereich dem Umschlagsbereich. Die Umschlagbereiche umfassen ca. 2 pH-Wert-Einheiten. Ein Umschlagbereich von etwa 2 pH-Wert-Einheiten resultiert daher, dass das Auge beispielsweise beim Indikator Methylrot die Farbe rot erst eindeutig bei einem Konzentrationsverhältnis Indikatorsäure : Indikatorbase von etwa 10 : 1 erkennt und entsprechend die Farbe gelb erst bei einem Verhältnis Säure : Base von etwa 1 : 10 eindeutig ist. Der Unterschied zwischen beiden Grenzen entspricht dem Faktor 100.
Ein Beispiel ist 1,4-Nitrophenol bzw. para-Nitrophenol, das im neutralen Bereich von farblos (sauer) nach tiefgelb (basisch) umschlägt:
![]()
Ein weiteres Beispiel ist Methylrot. Dieser Farbstoff, der zur Gruppe der Azofarbstoff gehört, schlägt von rot nach gelb um. Dieser Umschlag findet aber nicht im neutralen Bereich statt, sondern im Bereich von pH 4,2 bis 6,3. Es wird oftmals sauren Entkalkern (= Stoffe, die Geräte oder Maschinen vom abgelagerten Kalk des Wassers befreien) zugesetzt, um anzuzeigen, wann die Säure, die den Kalk auflöst, verbraucht ist.
Da die Reaktion in Abhängigkeit von der Stärke der Indikatorsäure oder -base verläuft, existieren unterschiedliche Umschlagbereiche und die Indikatoren sind für unterschiedliche pH-Bereiche einsetzbar.
-
Rotkohlsaft kann als Säure-Base-Indikator genutzt werden.

| Name | angezeigte Farben | pH-Umschlagsbereich | |
| < | |||
| Kresolrot | rot | gelb | 0,2-1,8 |
| Thymolblau | rot | gelb | 1,2-2,8 |
| Methylgelb | rot | gelb | 2,4-4,0 |
| Methylorange | rot | gelb | 3,1-4,4 |
| Methylrot | rot | gelb | 4,4-6,2 |
| Lackmus | rot | blau | 5,0-8,0 |
| Bromthymolblau | gelb | blau | 6,2-7,6 |
| Kresolrot | gelb | violett-rot | 7,0-8,8 |
| Thymolblau | gelb | blau | 8,0-9,8 |
| Phenolphthalein | farblos | rot | 8,0-9,8 |
| Alizaringelb R | gelb | orangebraun | 10,1-12,0 |
Von vielen Indikatoren existieren sowohl Lösungen als auch Teststreifen aus Papier (Bild 2).
-
Verfärbung von Universalindikator im Basischen und im Sauren

Arten von Indikatoren
Mischindikatoren enthalten mehrere Farbindikatoren und auch inerte Farbstoffe. Dadurch erfolgen je nach Konzentration der Hydronium-Ionen , d. h. je nach pH-Wert, mehrfache Farbwechsel beim Übergang von einer sauren zu einer basischen Lösung. Dadurch kann man auf einer pH-Skala von 1 bis 14 jeder Einheit eine Farbe zuordnen.
Das ist z. B. bei der Verwendung von Unitest-Papier zu beobachten, bei dem die Indikatoren auf einem Träger (Papier) aufgebracht sind. Gibt man nun einen Tropfen der Indikatorlösung zu einer Probe oder taucht ein Stück des Indikatorpapiers in die Lösung ein, so ändert sich, falls es keine neutrale Lösung ist, die Farbe. Diese Farbe kann man nun mit einer Farbskala vergleichen und erhält so den pH-Wert.
Derartige Indikatoren, die für jeden pH-Wert eine unterschiedliche Farbe anzeigen, werden auch als Universalindikatoren bezeichnet.
Weitere Indikatoren
Auch in der Natur können zahlreiche organische Substanzen mit der Änderung des pH-Wertes ihre Farbe ändern.
Rotkohl wird z. B. beim Ansäuern mit Essig rot. Je basischer das „Rotkohlwasser“ beim Kochen ist, um so mehr ändert sich die Farbe. Aus diesem Grund heißt Rotkohl in einigen Gegenden Deutschlands auch „Blaukraut“.
Andere Pflanzen wie Rittersporn, Preiselbeeren oder Geranien enthalten ebenfalls solche organischen Farbstoffe wie Anthocyane , die auf eine pH-Wert-Änderung mit einem Farbwechsel reagieren. Bei Hortensien hängt die Blütenfarbe vom pH-Wert des Bodens ab. Auf sehr sauren Böden (pH < 4,5) sind die Blüten violett, auf neutralen und alkalischen Böden meistens rosa oder rot. Blaue Blüten auf sauren Böden beruhen auf einem Aluminiumkomplex des Farbstoffs. So kann man durch Düngung mit dem Doppelsalz Alaun (KAl(SO4)2 blaue Blüten auf Dauer halten, da dieses Salz beim Lösen in Wasser sauer reagiert und Aluminium-Ionen angeboten werden.
Farbindikatoren sind bei weitem nicht auf Säure-Base-Reaktionen beschränkt. Organische Reduktions- bzw. Oxidationsmittel wirken bei Rededoxreaktionen als Indikatoren und zeigen bei den Verfahren der Redoxtitration (Redoxindikatoren) den jeweiligen Äquivalenzpunkt der Umsetzung an.
Auch in der Komplexometrie werden organische Komplexbildner als sogenannte Metallindikatoren verwendet.
-
pH-Bereiche