Eigenschaften von Komplexverbindungen
Bei der Komplexbildung treten sehr viele Eigenschaftsänderungen auf, die Eigenschaften des Komplexes unterscheiden sich oft deutlich von denen des Zentralions und der Liganden. Werden Komplexsalze in Wasser gelöst, bleiben oft die charakteristischen Reaktionen aus, die die freien, unkomplexierten Ionen eingehen würden. Die Stabilität des Komplexes ist dabei von entscheidender Bedeutung. In diesem Abschnitt werden die häufigsten und wichtigsten Eigenschaftsveränderungen vorgestellt, die bei einer Komplexbildung auftreten können.
Werden zu einer verdünnten Kupfersulfat-Lösung 2-3 Tropfen Ammoniak-Lösung gegeben, verändert sich die Farbe der Mischung, die ursprünglich hellblaue Lösung wird dunkelblau. Es läuft demzufolge eine chemische Reaktion ab. Hierbei handelt es sich weder um ein Säure-Base-Gleichgewicht noch um eine Redoxreaktion, sondern um einen weiteren Reaktionstyp, die Komplexbildung.
Grundlagen der Komplexchemie
Komplexe sind Verbindungen, die aus einem Zentralion bzw. Zentralatom und mehreren Liganden aufgebaut sind. Bei den Liganden kann es sich sowohl um Ionen als auch um Moleküle handeln, die Anzahl der Liganden eines Komplexes wird als Koordinationszahl bezeichnet, sie beträgt meistens 2, 4 oder 6. Die chemische Bindung wird koordinative Bindung genannt und kommt aufgrund einer Donor-Akzeptor-Wechselwirkung zwischen einer Lewis-Base und einer Lewis-Säure zustande. Die beiden Bindungselektronen stammen immer vom Liganden, der ein freies Elektronenpaar aufweisen muss und als Lewis-Base (Elektronenpaardonator) fungiert, das Zentralion wirkt als Lewis-Säure (Elektronenpaarakzeptor).
Zwischen den Einzelbestandteilen des Komplexes und dem Komplex stellt sich in der Lösung immer ein Dissoziationsgleichgewicht ein, das durch die Dissoziationskonstante beschrieben wird.
Stabile Komplexe haben eine kleine Dissoziationskonstante, die Liganden sind fest an das Zentralteilchen gebunden. Liegt letzteres in einer Lösung im Überschuss vor, gibt es praktisch keine freien Liganden mehr und die für den Liganden charakteristischen Reaktionen bleiben aus.
Bei schwachen Komplexen ist die Dissoziationskonstante groß, hier liegen also sowohl freie Zentralteilchen als auch freie Liganden in der Lösung vor, und ihre typischen Reaktionen finden in gewissem Maße statt.
Eigenschaftsänderungen bei der Komplexbildung
1) Farbigkeit der Lösung:
Je nach Art der Liganden ändert sich die Farbe eines Komplexes. In wässriger Lösung liegen Metallionen als Aquakomplexe, d. h. von Wasser komplexiert, vor. Gibt man nun andere Stoffe, die als Liganden wirken können hinzu, so kann ein anderer Komplex gebildet werden, wobei sich oft die Farbe der Lösung ändert.
Diese Farbänderung wird oft zum qualitativen Nachweis für Übergangsmetallionen genutzt. Ein Beispiel hierfür ist die Reaktion von in wässriger Lösung blassgelben Eisen(III)-Ionen mit Thiocyanat, bei der sich dunkelrotes Eisen(III)thiocyanat bildet (Bild 2).
Dass unterschiedliche Komplexe ein und desselben Metallions verschiedene Farben haben, lässt sich durch die Ligandenfeldtheorie erklären. Die fünf d-Orbitale des Zentralions werden bei der Komplexbildung „aufgespalten“, d. h. es entstehen zwei oder mehr Gruppen von d-Orbitalen mit unterschiedlichen Energieniveaus. Elektronen wechseln vom niedrigeren auf das höhere Niveau, wobei Strahlung mit bestimmter Wellenlänge absorbiert wird und die Komplementärfarbe der absorbierten Strahlung zu sehen ist. Wird z. B. rotes Licht absorbiert, so erscheint der Komplex grün. Vom Abstand der Energieniveaus hängt ab, welche Wellenlänge absorbiert wird und welche Farbe der Komplex hat. Der Abstand der Energieniveaus hängt vom Liganden ab – manche Liganden führen zu einer großen Aufspaltung, manche zu einer kleinen.
-
Farbänderung bei der Komplexbildung
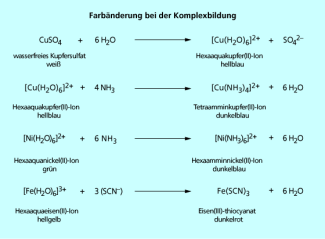
Da viele Metallsalze bei ihrer Hydratisierung ihre Farbe ändern, werden sie zum Teil als Feuchtigkeitsindikatoren genutzt. Ein gut geeigneter Feuchtigkeitsindikator ist Cobalt(II)chlorid, der z. B. im sogenannten Blaugel (Bild 3), einem Silicagel, vorhanden ist. Wasserfreies Cobalt(II)-chlorid ist hellblau. Da es hygroskopisch ist, nimmt es Wasser aus der Luft auf und bildet eine Hydrathülle aus. Es bilden sich blaues Cobalt(II)chlorid-Hydrat rosa Cobalt(II)chlorid-Dihydrat und dunkelrosa Cobalt(II)chlorid-Tetrahydrat . Solange das Salz nicht rosa ist, kann es noch Wasser aufnehmen.
Blaugel wird beispielsweise verwendet, um elektronische Geräte trocken zu halten, man findet es in vielen Geräteverpackungen in kleinen Säckchen. Außerdem sind „Wetterfiguren“ mit Cobalt(II)-chlorid beschichtet – je nach Luftfeuchtigkeit sehen sie blau oder rosa aus.
2) Änderung der Leitfähigkeit:
Mit Hilfe von Leitfähigkeitsmessungen lässt sich untersuchen, ob sich ein Komplex gebildet hat, denn die elektrische Leitfähigkeit einer Lösung hängt u. a. davon ab, in wie viele Ionen ein Salz dissoziiert. Bei geringen Salzkonzentrationen ist die Art der Ionen für die Leitfähigkeit kaum von Bedeutung. Ist die Summe der elektrischen Leitfähigkeiten der Einzellösungen wesentlich größer als die elektrische Leitfähigkeit der Mischung, hat sich ein Komplex gebildet, da die Komplexbildung die Anzahl der Ionen verringert, die frei in der Lösung vorliegen.
Würde Kaliumhexacyanoferrat-(II) vollständig in seine Einzelbestandteile dissoziieren, also in vier Kalium-, ein Eisen(II)- und sechs Cyanid-Ionen, entspräche die Leitfähigkeit der Lösung der Summe der Einzelleitfähigkeiten. Da dies nicht der Fall ist, liegt ein Komplex-Ion vor.
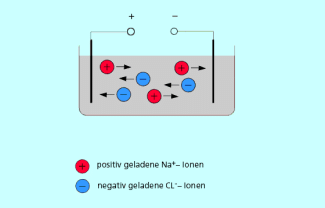
3) Änderung der Wanderungsrichtung im elektrischen Feld:
Legt man an eine Salzlösung eine Gleichspannung an (Bild 4), so entsteht ein elektrisches Feld zwischen den beiden Elektroden.
Ionen sind geladene Teilchen und bewegen sich entsprechend ihrer Ladung, und zwar die Kationen zur Kathode und die Anionen zur Anode. Ein typisches Metallion, das positiv geladen ist, wandert also zur Kathode. Bildet sich ein Komplex aus einem Metallion und negativ geladenen Liganden, entstehen Komplexionen, die je nach Ladung des Kations und nach Zahl und Ladung der Liganden elektrisch neutral oder negativ geladen sind. Diese wandern dann im elektrischen Feld entweder nicht mehr oder zur anderen Elektrode (Anode). Bleibt das Komplexion positiv geladen, ändert sich Wanderungsrichtung nicht.
4) Änderung kolligativer Eigenschaften
Als kolligative Eigenschaften werden solche Stoffeigenschaften bezeichnet, welche nur von der Konzentration, also der Teilchenzahl und nicht von der Art der Teilchen abhängen (lat. colligare - verbinden, zusammenschließen). Zu ihnen gehören z. B. der osmotische Druck und die Gefrierpunktserniedrigung bzw. die Siedepunktserhöhung. Sie sind proportional zur Stoffmenge.
Da sich bei der Komplexbildung die Gesamtzahl der Teilchen verringert, ist die Komplexbildung an der Veränderung der kolligativen Eigenschaften nachweisbar. Dies lässt sich eindeutig belegen, z. B. durch Messung des osmotischen Druckes oder der Gefrierpunktserniedrigung.
5) Magnetismus
Was das Verhalten im magnetischen Feld angeht, so lassen sich zwei Arten von Stoffen unterscheiden:
Diamagnetische Stoffe werden von einem Magnetfeld abgestoßen, sie erhalten nur gepaarte Elektronen.
Paramagnetische Stoffe enthalten ungepaarte Elektronen, sie werden von einem Magnetfeld angezogen, und zwar um so stärker, je mehr ungepaarte Elektronen sie enthalten.
Der Magnetismus bei Komplexen lässt sich wie die Farbigkeit gut mit der Ligandenfeldtheorie erklären. Er hängt davon ab, welche d-Orbitale mit wie vielen Elektronen besetzt werden. Bei oktaedrischen Komplexen findet eine Aufspaltung der d-Orbitale in zwei unterschiedliche Energieniveaus statt, es entstehen eine Gruppe aus drei energetisch günstigeren Orbitalen und eine Gruppe aus zwei energetisch höher liegenden Orbitalen. Bei Komplexen mit bis zu drei d-Elektronen gibt es nur eine Möglichkeit, die Orbitale zu besetzen, ebenso bei Komplexen mit 8-10 d-Elektronen. Sind hingegen 4-7 d-Elektronen zu verteilen, so gibt es zwei Möglichkeiten zur Verteilung der Elektronen, abhängig von der Größe der Aufspaltung der d-Orbitale. Ist die Aufspaltung groß, so werden zunächst die energetisch tiefer liegenden Orbitale erst einfach und dann doppelt besetzt, wie es der hundschen Regel und dem paulischen Aufbauprinzip entspricht. Es entstehen „Low-Spin-Komplexe“, die die maximale Anzahl an gepaarten Elektronen besitzen.
Ist die Aufpaltung hingegen klein, so werden alle fünf d-Niveaus zunächst einfach und dann doppelt besetzt. Im Gegensatz zum ersten Fall sind also mehr ungepaarte Elektronen vorhanden, es werden „High-Spin-Komplexe“ gebildet, die einen höheren Paramagnetismus aufweisen als die entsprechenden Low-Spin-Komplexe.
Das Verhalten im Magnetfeld wird also durch die Komplexbildung unter Umständen deutlich verändert.
Komplexbildung und chemische Reaktivität
1) Auflösen schwer löslicher Salze
Wird Silbernitratlösung mit etwas Salpetersäure angesäuert und danach ein Tropfen Kochsalzlösung zugegeben, fällt weißes Silberchlorid aus. Dies ist ein schwerlösliches Salz, welches beispielsweise durch Verdünnen mit Wasser nicht wieder in Lösung gebracht werden kann. Gibt man jedoch Ammoniak-Lösung hinzu, löst sich der weiße Niederschlag auf. Silber-Ionen gehen mit Ammoniak einen stabilere Verbindung ein als mit Chlorid-Ionen. Es entstehen Diamminsilber(I)-Ionen. Der Ammoniak entzieht dem Fällungsgleichgewicht die Silber-Ionen, welche sich immer wieder nachbilden, wodurch es zur Auflösung des Silberchloridniederschlages kommt.
Ob sich schwer lösliche Salze durch Komplexbildung auflösen lassen, hängt vom Verhältnis des Löslichkeitsproduktes zur Komplexbildungskonstante ab. Ist diese groß genug, kann durch Zugabe des Komplexliganden im Überschuss der Niederschlag aufgelöst werden.
2) Maskierung von Ionen
Unter Maskierung versteht man die vollständige Komplexierung der Metallionen, die in einer Lösung enthalten sind. Um dies zu erreichen, wird ein Ligand, der mit dem zu maskierenden Metallion einen stabilen Komplex bildet, im Überschuss hinzugegeben. Die typischen Reaktionen des Metallions bleiben bei physikalischen Messungen oder weiteren chemischen Reaktionen aus. Als Maskierungs-Ligand ist beispielsweise Ethylendiamintetraessigsäure (EDTA) sehr gut geeignet.
-
Stromfluss in einer Salzlösung
-
Verschiedene Komplexionen mit ihrer Ausrichtung im elektrischen Feld

Natürlich können durch Komplexbildung auch die typischen Reaktionen von Liganden verhindert werden, indem man entsprechende Metallionen zu einer Lösung des Liganden gibt.
So binden beispielsweise Eisen(II)-Ionen, die im Überschuss zu einer hochgiftigen Kaliumcyanid-Lösung gegeben werden, durch Komplexbildung die enthaltenen Cyanid-Ionen. Die Lösung ist nach vollständiger Komplexierung ungefährlich, da die Cyanid-Ionen im Komplex fest gebunden sind und daher nicht mehr in typischer Weise reagieren können.
-
Beispiele für das Ausbleiben bestimmter Ionenreaktionen aufgrund von Komplexbildung

Suche nach passenden Schlagwörtern
- Ionenreaktionen
- Koordinationsverbindung
- Farbänderung
- elektrische Leitfähigkeit
- elektrisches Feld
- Komplex
- Maskierung
- Lewisbase
- Ligand
- Koordinationszahl
- Zentralion
- Magnetismus
- Lewissäure
- WERNER
- Kolligative Eigenschaften
- Feuchtigkeitsindikator
- Ligandenaustauschreaktion
- Dissoziationsgleichgewicht
- Gefrierpunktserniedrigung
- Löslichkeit

