Citratzyklus
Der Citratzyklus ist eine 1937 von HANS ADOLF KREBS (1900-1981), G. MARTIUS und F. KNOOP etwa gleichzeitig entdeckte zyklische biochemische Reaktionskette, welche in allen lebenden Zellen abläuft. Er verläuft unter Beteiligung von Zitronensäure (Citrat), die zum Zwecke der Gewinnung von Reduktionsäquivalenten in andere organische Säuren umgewandelt wird. Er oxidiert in acht Schritten Acetyl-Reste zu Wasser und Kohlenstoffdioxid. Die dabei gewonnenen Reaktionsprodukte werden an die Atmungskette weitergegeben. Durch anschließende oxidative Phosphorylierung gewinnt die Zelle aus diesem Vorgang 10 ATP pro Acetyl-Gruppe.
Außerdem erfüllt der Citratzyklus eine Schlüsselfunktion im intermediären Stoffwechsel der Zelle. Er verbindet den energieliefernden Endabbau des aus dem Protein-, Fett- und Kohlenhydratstoffwechsel stammenden Zwischenprodukts Acetyl-Coenzym A mit der Erzeugung zahlreicher Vorstufen für anabole Biosynthesewege.
Der Citratzyklus ist die „Drehscheibe“ des Stoffwechselsystems. Seine wichtigste Funktion ist die Produktion von NADH für die Atmungskette. Der im NADH gebundene Wasserstoff wird in der Mitochondrienmembran mit molekularem Sauerstoff zu Wasser oxidiert. Die dabei frei werdende Energie wird zur ATP-Synthese genutzt. Dieser auch als oxidative Phosphorylierung bezeichnete Vorgang ist der effizienteste ATP-produzierende Prozess.
Der Citratzyklus ist ein bei allen sauerstoffverbrauchenden Lebewesen mit der Atmungskette verbundener Zyklus im Zentrum des Stoffwechsels. Er läuft in den Mitochondrien von Eukaryoten sowie im Cytoplasma von Prokaryoten ab. Er ist Teil der Zellatmung und geht bei aeroben Organismen den eigentlichen Oxidationsprozessen der Atmungskette voraus. Der Citratzyklus ist der dritte von vier Schritten im Kohlenhydrat-Katabolismus (dem Abbau von energiereichen, Kohlenstoff enthaltenden Verbindungen). Er findet nach der Glykolyse und der oxidativen Decarboxylierung und unmittelbar vor der Atmungskette statt.
Unter Wasser- und erfolgt ein energieliefernder, oxidativer Abbau zugeführter Kohlenhydrate, Fette und Eiweiße. In den Citratzyklus tritt als Kohlenstoffverbindung das Abbauprodukt der Glucose oder einer Fettsäure, die sogenannte aktivierte Essigsäure (d.h. ein an ein Coenzym gebundener Essigsäure-Rest) ein, um im Zyklus vollständig zu Kohlenstoffdioxid abgebaut zu werden.
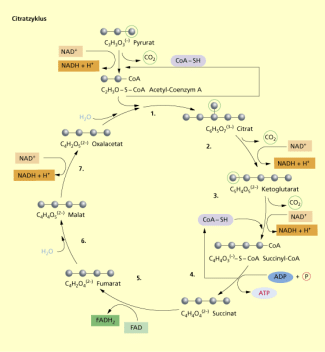
Ein Transportprotein befördert das Pyruvat aus dem Cytoplasma in die Matrix des Mitochondriums. Hier wird abgespalten, das aus der Zelle hinaus diffundiert. Unter Abgabe von Elektronen und Protonen und Aufnahme des Coenzyms A wird der Rest zu Acetyl-CoA oxidiert und reduziert. Als Enzymkomplex wirkt Pyruvat-Dehydrogenase. Mit Acetyl-CoA ist ein Substrat entstanden, das in den Citratzyklus eintritt.
Bei der vollständigen Oxidation eines Moleküls Glucose entstehen insgesamt etwa 38 Moleküle ATP, zwei in der Glykolyse, zwei im Citratzyklus und 34 in der oxidativen Phosphorylierung.
| Reaktionsschritte: | |
| (1) | Acetyl-CoA reagiert mit Oxalacetat zu Citrat . Das freigesetzte Coenzym A kann ein weiteres Pyruvat binden. Da alle Substrate als Ionen vorliegen, verwendet man heute die Bezeichnung der Anionen. Früher benannte man die beteiligten Säuren z. B. Zitronensäure. |
| (2) | Unter Abspaltung und gleichzeitiger Aufnahme von Wasser wird das Isomer Isocitrat gebildet. |
| (3) | Aus dem Substrat wird abgespalten und Elektronen und Protonen an übertragen. Alpha-Ketogluterat wird gebildet. |
| (4) | Ein weiteres -Molekül wird abgespalten. Unter Abgabe von Elektronen und Protonen an wird das Restsubstrat oxidiert und an das Coenzym A gekoppelt. Bildung von Succinyl-CoA. |
| (5) | Das Coenzym A wird wieder freigesetzt. Über Zwischenreaktionen entstehen 2 Moleküle ATP, der einzige Energiegewinn im Citratzyklus. Dabei wird Succinat gebildet. |
| (6) | Bei der Oxidation des Substrates werden die Wasserstoffatome auf FAD übertragen. FAD ist dem ähnlich. Es wirkt auch als Elektronenakzeptor (FAD = Flavinadenindinucleotid ). Bildung von Fumarat. |
| (7) | Bei dieser Reaktion werden Bindungen im Substrat unter Addition von Wasser umgelagert. Bildung von Malat. |
| (8) | Durch Elektronen- und Protonenübertragung auf entsteht wieder Oxalacetat. Durch die Regeneration dieser Verbindung wird der zyklischen Verlauf möglich. Bildung von Oxalacetat. |
Enzyme im Citratzyklus
| Folgende Enzyme sind am Citratzyklus beteiligt: | |
| 1 | Citrat-Synthase |
| 2 | Aconitase |
| 3 | Isocitrat-Dehydrogenase |
| 4 | Ketoglutarat-Dehydrogenase |
| 5 | Succinyl-CoA-Synthase |
| 6 | Succinat-Dehydrogenase |
| 7 | Fumarase |
| 8 | Malat-Dehydrogenase |
-
Citratzyklus