Ascorbinsäure – wichtig als Vitamin C, doch keine Carbonsäure
Ascorbinsäure ist eine ringförmige Verbindung, die besser unter dem Namen Vitamin C bekannt ist. Obwohl der Stoff keine Carbonsäure ist, kann das Molekül zwei Protonen abgeben. Darauf und auf der reduzierenden Wirkung basiert der Einsatz als Konservierungsstoff in der Lebensmittelindustrie.
Dieser ist für die Industrie auch deshalb so interessant, weil Vitamin C einen essenziellen Stoff für den menschlichen Organismus darstellt. Ascorbinsäure ist an der Biosynthese von Hormonen und anderen Eiweißen beteiligt, stärkt das Immunsystem und wirkt als Radikalfänger. Die empfohlene tägliche Aufnahme von Vitamin C beträgt 70-100 mg, unter bestimmten Umständen sogar mehr. Allerdings sollte diese nicht im Zusammenhang mit Süßigkeiten, sondern durch vitaminreiche Obst- und Gemüsesorten aufgenommen werden.
Ascorbinsäure (Vitamin C)
Haben Bonbons den Aufdruck „Mit mehr Vitamin C“, verlockt diese Aufschrift viele Mütter zum Griff ins Süßwarenregal, obwohl sie zu viele Süßigkeiten für ihre Kinder sonst eher ablehnen. Diese Aufschrift lässt uns jedoch vermuten, dass die Bonbons ein wenig zur Gesunderhaltung des Körpers beitragen könnten. Regt uns diese Aufschrift nicht sogar bei Säften, Marmeladen, Sauerkraut, Gummibären und selbst bei Schmerzmitteln eher zum Kauf an? Steckt in der Werbung ein Körnchen Wahrheit?
Vitamin C ist tatsächlich eine multifunktionelle, für unseren Körper essenzielle Substanz. Er kann von unserem Organismus nicht produziert werden, muss also mit der Nahrung täglich zugeführt werden. Es gehört zu den wasserlöslichen Vitaminen.
Seit Jahrhunderten beobachteten Seefahrer, dass die gefährliche Krankheit Skorbut besonders auf langen Passagen auftrat. Dann kam es zu Symptomen wie Zahnfleischbluten und Zahnausfall, Erschöpfungszuständen, schlechte Wundheilung, hohem Fieber und schließlich starben die Betroffenen. Die Krankheit trat nicht auf, wenn den Matrosen auf langen Seereisen frisches Obst und Gemüse zur Verfügung stand. Der österreichische Militärarzt Kramer schrieb: „Man nehme Zitronensaft und mache daraus ein Limonadi.“ Dem englischen Kapitän Cook gelang es durch eine uns erstaunende Anweisung den Ausbruch der Krankheit auf seinen Schiffen zu stoppen. Jedes Mitglied der Crew musste pro Woche 1 kg Sauerkraut konsumieren. Nicht nur, dass es sich dabei um ein wenig verderbliches Lebensmittel handelte, wir wissen heute, dass Sauerkraut den so lebensnotwendigen Stoff Vitamin C in großen Mengen (etwa 25 mg pro 100 g Sauerkraut) enthält.
Man geht in Deutschland heute davon aus, dass die Aufnahme von etwa 70 - 100 mg Vitamin C pro Tag eine optimale Dosis darstellen. Schwerstarbeit, Rekonvaleszenz, Alkohol, Rauchen und Stress erfordern einen höheren Konsum. Am besten deckt man den täglichen Bedarf durch frisches Obst und Gemüse und deren Tiefkühlvariationen, sowie durch Säfte. Dabei kommt es darauf an, dass Obst und Gemüse wirklich frisch ist, denn Vitamin C ist zwar hitzestabil, wird aber unter dem Einfluss von Luft (Sauerstoff) abgebaut (Bild 3). Der Gehalt sinkt entsprechend.
Folgende Obst- und Gemüsesorten enthalten besonders viel Vitamin C. (Die Werte beziehen sich immer auf das rohen Frischprodukt):
| Acerola-Kirsche: | 1700 | mg pro 100g |
| Hagebutte: | 250 | mg pro 100g |
| Sanddorn: | 450 | mg pro 100g |
| Schwarze Johannesbeere: | 189 | mg pro 100g |
| rote Paprika: | 180 | mg pro 100g |
| Grünkohl: | 140 | mg pro 100g |
| Petersilienkraut: | 166 | mg pro 100g |
| Kiwi: | 150 | mg pro 100g |
| Broccoli: | 110 | mg pro 100g |
| Rosenkohl: | 102 | mg pro 100g |
| Blumenkohl: | 69 | mg pro 100g |
| Kohlrabi: | 66 | mg pro 100g |
| Erdbeere: | 62 | mg pro 100g |
| Zitrone: | 53 | mg pro 100g |
| Spinat: | 51 | mg pro 100g |
| Orange: | 50 | mg pro 100g |
| Geflügelleber: | 28 | mg pro 100g |
| Sojakeimlinge: | 21 | mg pro 100g |
Der hohe Gehalt an Vitamin C in Paprika veranlasste 1933 den Nobelpreisträger Szent-Györgyi (er forschte selbst an der Isolierung des Vitamins) der Firma Merck seine Hilfe anzubieten. Er wollte bei der Beschaffung großer Mengen an Paprikaschoten behilflich sein, um die Isolierung in technischen Maßstäben aus dem Naturprodukt zu ermöglichen. Szent-Györgyi und Haworth benannten das Vitamin C als „ Ascorbinsäure “, um damit auf antiskorbutische Wirkung hinzuweisen. Aus vielen einheimischen Pflanzen versucht die Firma Merck Vitamin C zu gewinnen, sogar ein Gladiolenfeld wurde angelegt, dessen Gesamtausbeute 12 kg Vitamin C betrug.
1933 wurde die Struktur der Ascorbinsäure aufgeklärt (Bild 2), noch im selben Jahr gelang die Laborsynthese. So wurde 1933 die erste Vitamin-C-Tablette gepresst und zur Testung freigegeben.
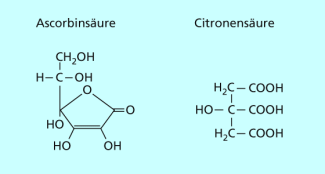
Zitrusfrüchte werden allgemein mit einem hohen Vitamin-C-Gehalt assoziiert. Natürlich gehört dieser Stoff zu den wichtigen Inhaltsstoffen von Zitronen, Apfelsinen, Mandarinen und anderen Zitrusfrüchten. Diese haben ihren Name allerdings nach dem hohen Gehalt an Citronensäure bekommen. Vitamin C (Ascorbinsäure) und Citronensäure haben einen völlig verschiedenen Aufbau und dürfen nicht miteinander verwechselt werden. Citronensäure ist eine Carbonsäure, weil sie mehrere Carboxyl-Gruppen enthält (-COOH).
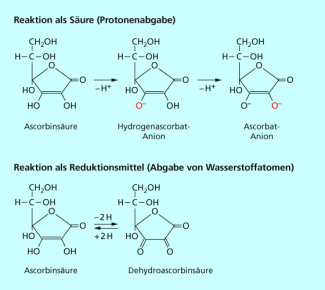
Schaut man sich jedoch die Strukturformel der Ascorbinsäure an, fällt auf, dass sie keine Carboxyl-Gruppe besitzt (Bild 2). Da Carbonsäuren mindestens eine COOH-Gruppe enthalten, gehört Ascorbinsäure nicht zu dieser Stoffklasse.
Die saure Reaktion des Vitamin C beruht jedoch trotzdem auf seiner Fähigkeit zur Protonenabgabe. Diese erfolgt an den beiden OH-Gruppen des Ringsystems. Experimentell konnte festgestellt werden, dass die Hydroxyl-Gruppe am 3. C-Atom des Ringes sein Proton leichter abgibt als die benachbarte OH-Gruppe am 2. C-Atom.
Zudem fällt auf, dass die Struktur stark an Zuckermoleküle erinnert. Aufgrund dieser Verwandtschaft kann man bei der industriellen Synthese von Vitamin C auf Zucker als Ausgangsstoffe zurückgreifen.
-
Ascorbinsäure (Vitamin C) und Citronensäure weisen völlig unterschiedliche Strukturen auf.
Ascorbinsäure wird in wässrigen Lösungen sehr leicht zu Dehydroascorbinsäure oxidiert (Bild 3). Dabei werden die beiden schon besprochenen Protonen und zwei Elektronen an den Reaktionspartner abgegeben. Aufgrund der reduzierenden Wirkung sind speziell wässrige Lösungen von Ascorbinsäure nicht lange stabil. Frisches geschnittenes oder geschältes Obst, frisch bereitete Salate sollten sofort verzehrt werden, denn an der Luft erfolgt die Reaktion mit der Ascorbinsäure mit Sauerstoff und somit wird dieses wichtige Vitamin zerstört.
Aus dem gleichen Grund wird Vitamin C auch in der Lebensmittelindustrie als Antioxidationsmittel also letztlich als „Konservierungsstoff eingesetzt (60 % der jährlichen Ascorbinsäureproduktion werden dort verbraucht). Die betroffenen Produkte tragen die Nummern E300-E304.
Der Inhaltsstoff Ascorbinsäure bewahrt Obst oder frische Obstsäfte vor dem Braunwerden. Sie reagiert selbst sofort mit dem Luftsauerstoff und reduziert außerdem bereits im Obst durch Sauerstoff gebildete farbige Chinone zu den Ausgangsstoffen dieser Oxidationen, zu farblosen Phenolen.
Außerdem schützt das saure Verhalten der Verbindung zusätzlich vor störenden Keimen, wodurch eine zusätzliche konservierende Wirkung erzielt wird.
Im menschlichen Körper ist die Substanz von überragender Bedeutung. Nicht nur lebensnotwendige Hormonen wie z. B. Serotonin und Adrenalin werden nur in Gegenwart von Ascorbinsäure gebildet, auch die Bildung von Collagen ist ohne den Stoff im Organismus nicht möglich. Ascorbinsäure hat zudem nachweisbar positive Wirkung auf das Immunsystem, daher erklärt sich auch die erhöhte Infektionsanfälligkeit bei Vitamin-C-Mangel.
Haben sich durch eine besondere Arbeitsplatzbedingungen (z. B. Zahnarzt) Schwermetall-Ionen (Quecksilber-, Blei-, Cadmium-Ionen) im Körper angesammelt, ist Vitamin C in der Lage, diese an sich zu binden und aus dem Körper abzutransportieren.
Des Weiteren wirkt Vitamin C als sogenannter Radikalfänger, also von Atomen bzw. Molekülen, die aufgrund ihrer unvollständigen Elektronenkonfiguration sehr reaktiv sind. Durch Strahlungsbelastung (in der Haut auch durch UV-Strahlung) oder auch durch ablaufende chemische Reaktionen kommt es in der Zelle zur Bildung äußerst aggressiver Radikale. Diese sind in der Lage empfindliche Zellorganellen anzugreifen, im schlimmsten Fall DNA-Strukturen zu verändern und können daher zum Entstehen vieler Krankheiten, auch von Krebserkrankungen, beitragen. Vitamin C inaktiviert solche Radikale und trägt auch so zu unserer Gesundheit bei.
In Anbetracht dieser positiven Wirkungen im Organismus ist eine ausreichende Versorgung mit Vitamin C wichtig. Allerdings sollte man dazu nicht unbedingt auf Bonbons zurückgreifen, die mit dieser Substanz angereichert sind, denn diese Süßwaren enthalten genauso viel Zucker wie andere Süßigkeiten. Ob sie also „gesünder“ sind als andere Bonbons darf bezweifelt werden.
Bei dieser so überzeugenden Funktionsvielfalt der Ascorbinsäure im Organismus könnte man versuchen, durch Einnahmen hoher Dosen des Superstoffs eine Verlängerung der Lebenszeit zu bewirken. Ausgezeichnete Wissenschaftler wie der Nobelpreisträger Linus Pauling vertraten diese Ansicht. Bis zu 3 g täglich, empfahl der Wissenschaftler, in Krisenzeiten mehr. Er ging davon aus, dass nicht verstoffwechseltes Vitamin C einfach nur wieder ausgeschieden wird.
Heute ist diese Überdosierung nicht unumstritten. Es kann bei derartigen Einnahmen des Vitamins zu Schlafstörungen, Diarrhöe oder Gereiztheit kommen. Viel bedenklicher erscheinen jedoch Studien, die auf einen Zusammenhang zwischen die Entstehung von Bronchialkrebs und chronischer Überdosierung des Stoffes hinweisen.
Bis heute kann eine eindeutige Antwort zu schädlichen Wirkungen von Vitamin C nicht gegeben werden. Ziemlich sicher scheint, dass durch eine gesunde, vitaminreiche Ernährung das Risiko der Entartung gesunder Zellen und durch Vitalisierung des Bindegewebes die Ausbreitung von Krebszellen vermindert werden kann.
Offenbar bestätigt sich sogar beim Vitamin C der Ausspruch von PARACELSUS: „Die Menge macht das Gift.“
-
Ascorbinsäure kann als Säure oder als Reduktionsmittel reagieren.