Bändermodell
Die Metallbindung ist eine Art der chemischen Bindung, die durch Anziehungskräfte zwischen Metall-Ionen und freien Elektronen verursacht wird. Die meisten Metalle der Hauptgruppen besitzen nur wenige Außenelektronen. Diese Außenelektronen der Metalle können leicht vom Metall-Atom abgegeben werden, da die Atomkerne auf die Außenelektronen nur geringfügige Anziehungskräfte ausüben. Dadurch entstehen positiv geladene Metall-Ionen und nahezu frei bewegliche Elektronen. Diese frei beweglichen Elektronen ermöglichen die gute elektrische Leitfähigkeit und die hohe Wärmeleitfähigkeit der Metalle.
Um die Bindung von Metallen zu veranschaulichen, gibt es zwei Modelle: das Bändermodell und das Elektronengasmodell.
Die Metallatome liegen in einem geordneten Gitter mit freien Elektronen vor. Die Bindung bei Metallen lässt sich durch das Elektronengasmodell und das Bändermodell erklären.
Mit dem Bändermodell und Elektronengasmodell können die elektrischen und Wärmeleiteigenschaften von allen Stoffen anschaulich und ohne Widersprüche erklärt werden. Damit lassen sich auch Aussagen über die Leitfähigkeit von Metallen, Halbleitern und Isolatoren machen.
Das Bändermodell
Grundlagen des Bändermodells sind die Molekülorbital-Theorie und das PAULI-Prinzip.
Im Metall liegen die Atome in einer dichten, dreidimensionalen Anordnung vor. Geht man zunächst gedanklich von zwei Atomen, die ein Molekül bilden aus, so kombinieren die zwei Atomorbitale zu zwei Molekülorbitalen (MOs) – bindend und antibindend. Aus sehr vielen (n) Atomorbitalen werden genau so viele (n) MOs gebildet. Alle MOs müssen sich nach dem PAULI-Prinzip mindestens in einer quantenchemischen Bedingung – und damit energetisch – unterscheiden.
Bei n kombinierten Atomorbitalen wird die Energiedifferenz zwischen den MOs einer Hauptquantenzahl so gering, dass zwischen den Energieniveaus der einzelnen MOs nicht mehr differenziert werden kann. Sie werden praktisch ununterscheidbar und bilden ein Energieband. Das höchste mit Elektronen besetzte Band bezeichnet man als Valenzband, während das niedrigste unbesetzte Band Leitungsband heißt, weil es eine zentrale Rolle bei der Leitung des elektrischen Stroms spielt.
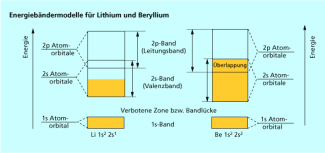
Lithium besitzt nur ein Valenzelektron, sodass das 2s-Band als Valenzband nur halb besetzt ist (Bild 2). Die Elektronen liegen delokalisiert im Valenzband vor und sind frei beweglich. Sie können freie MOs im Valenz- und im Leitungsband besetzen und so den elektrischen Strom leiten, ohne das PAULI-Prinzip zu verletzen.
Beim Beryllium dagegen ist das Valenzband voll besetzt, so dass innerhalb dieses Energiebandes keine elektrische Leitung möglich wäre (Bild 2). Aufgrund der Überlappung mit dem leeren 2p-Band können die Elektronen jedoch freie MOs im Leitungsband besetzen, wo sie wieder frei beweglich sind und so den elektrischen Stromfluss ermöglichen.
Aus der Metallbindung resultieren weitere wichtige Eigenschaften der Metalle. Da in Metallen Bänder vorliegen, können sich sehr viel dichtere Gitterstrukturen bilden. Man findet in Abhängigkeit von dem Atomdurchmesser nur drei bedeutende Gittertypen: Hexagonal dichteste Kugelpackung, kubisch dichteste Kugelpackung, kubisch innenzentrierte Kugelpackung.
![]()
-
Energiebändermodelle
Bei den dichtesten Kugelpackungen lassen sich zwei Typen unterscheiden, die kubisch-dichteste und die hexagonal-dichteste Kugelpackung. Bei beiden werden die verschiedenen Schichten so aufeinandergestapelt, dass sich die Atome der nächsten Schicht jeweils in den Lücken der darunter liegenden Schicht befinden. Bei der hexagonal-dichtesten Kugelpackung (Bild 3) liegen die Atome der dritten Schicht genau über denen der ersten Schicht. Da sozusagen Schicht A wiederholt wird, spricht man auch von einer Schichtenfolge ABAB.
Bei der kubisch-dichtesten Kugelpackung (Bild 4) hingegen liegen die Atome der dritten Schicht nicht genau über denen der ersten Schicht, sondern über den gemeinsamen Lücken der ersten und zweiten Schicht. Erst die vierte Schicht ist deckungsgleich mit der ersten. Man bezeichnet die Schichtenfolge daher auch als ABCABC...
Die Elementarzelle des kubisch innenzentrierten Gitters (Bild 5) ist ein Würfel, bei dem Zentrum und Ecken von Atomen besetzt sind.
Metalle sind häufig duktil, d. h., sie lassen sich verformen, wobei Atomschichten im Gitter gegeneinander verschoben werden. Besonders gut verformbar sind Gold, Silber, Blei und Kupfer, die zum Typ der kubisch dichtesten Kugelpackung gehören.
Leiter, Halbleiter und Isolatoren im Bändermodell
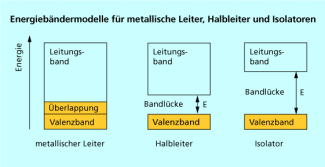
Die gegenseitige Anordnung von Valenz- und Leitungsband bestimmt das elektrische Verhalten der Festkörper.
Bei den Metallen ist die Energiedifferenz zwischen s- und p-Orbitalen so klein, dass Leitungs- und Valenzband miteinander überlappen.
Damit stehen im Leitungsband der Metalle auch ohne äußere Energiezufuhr ständig Elektronen zur Verfügung. Beim Anlegen einer Spannung fließt ein Strom.
Es könnte angenommen werden, dass bei Temperaturerhöhung die elektrische Leitfähigkeit der Metalle steigt, da Elektronen vermehrt angeregt werden, in energetisch höhere Leitungsbänder zu wechseln. Das ist jedoch nicht der Fall; vielmehr verringert sich die Leitfähigkeit bei Temperaturerhöhung. Das hängt mit der vermehrten Kollision der Elektronen untereinander aufgrund ihrer höheren kinetischen Energie zusammen.
Anders verhält es sich bei den Halbleitern , z. B. Silicium, die bei Temperaturerhöhung eine erhöhte Leitfähigkeit zeigen. Bei Halbleitern befindet sich zwischen Valenz- und Leitungsband eine relativ geringe „Bandlücke“, die erst bei energetischer Anregung durch Wärmezufuhr von den Elektronen übersprungen werden kann. Das bedeutet, dass bei tiefen Temperaturen das Leitungsband praktisch leer, das Valenzband voll besetzt ist: Das Material verhält sich wie ein Isolator. Bei Zimmertemperatur kann die erforderliche Mindestenergie aber aufgebracht werden, es gehen Elektronen aus dem Valenzband ins Leitungsband über, das Material wird leitend.
Eine strenge Abgrenzung zwischen Halbleitern und Isolatoren gibt es nicht. Bei Isolatoren ist die „Bandlücke“ relativ breit, das Leitungsband ist weitgehend leer. Sie würden bei thermischer Anregung eher schmelzen oder verdampfen, als dass die Bandlücke von den Elektronen übersprungen werden kann (Bild 6).
-
Energiebändermodelle bei Leiter, Halbleiter, Isolator
Elektronengasmodell
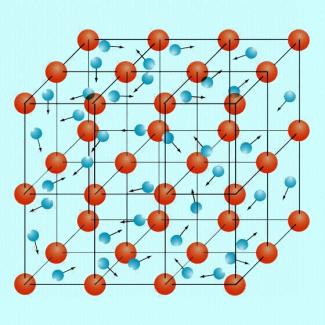
Die Bindung bei Metallen lässt sich auch durch das sogenannte Elektronengasmodell erklären. Die Metallatome liegen in einem geordneten Gitter vor und geben ihre Valenzelektronen ab, sodass ein „Elektronengas“ aus frei beweglichen Elektronen entsteht, das durch elektrostatische Anziehung die positiv geladenen Atomrümpfe zusammenhält. Weil die Bindungskräfte gleichmäßig in alle Raumrichtungen wirken und nicht nur zwischen bestimmten Atomen, spricht man auch von einer ungerichteten Bindung (Bild 7).
Die Metallatomschichten lassen sich gut gegeneinander verschieben, weil sie immer vom Elektronengas zusammengehalten werden. Aufgrund dessen sind Metalle meist gut verformbar. Bei Legierungen werden Fremdatome ins Metallgitter eingebaut. Durch die unterschiedliche Größe der Atome wird die Verschiebbarkeit innerhalb des Gitters eingeschränkt; Legierungen sind daher oft härter und spröder als die reinen Metalle, aus denen sie bestehen. Ein typisches Beispiel ist die Bronze, die hauptsächlich aus den Metallen Kupfer und Zinn gebildet wird.
Leiter
Die hohe Beweglichkeit der Elektronen des Elektronengases führt dazu, dass beim Anlegen eines elektrischen Feldes eine gerichtete Bewegung der Elektronen erfolgt. Allerdings darf man sich die Elektronenbewegung im Metall nicht als völlig geordnet vorstellen. Ähnlich wie die Teilchen eines idealen Gases bewegen sich auch die Elektronen in verschiedenen Raumrichtungen. Ein elektrisches Feld verleiht ihnen zusätzlich zu dieser ungeordneten Bewegung eine gerichtete Geschwindigkeitskomponente, sodass die Ladungsträger in einer bestimmten Richtung zu driften beginnen. Daher rührt die Bezeichnung Driftgeschwindigkeit für diese Geschwindigkeitskomponente. Sie liegt bei den üblichen Stromstärken bei metallischen Leitern in der Größenordnung von Millimetern je Sekunde.
Halbleiter
In Halleitern sind bei tiefen Temperaturen praktisch alle Elektronen im Valenzband. Bei den Elementen der 4. Hauptgruppe wie Silicium und Germanium ist dieses dann vollständig besetzt, sodass kein Strom fließen kann. Aber bereits bei Zimmertemperatur haben die Elektronen ausreichend Energie, um die Bandlücke zu überwinden und in das Leitfähigkeitsband übergehen. Die Leitfähigkeit nimmt dann mit der Temperatur stark zu (Thermische Eigenleitung). Im Halbleiter sind dann freie Elektronen und Fehlstellen, die man als Löcher oder Defektelektronen bezeichnet, vorhanden. Diesen Effekt nennt man Paarbildung, den umgekehrten Effekt der Besetzung einer Fehlstelle durch ein Elektron Rekombination. Im statistischen Mittel halten sich Paarbildung und Rekombination die Waage. Es sind aber immer freie Elektronen und Defektelektronen vorhanden.
Bei Anlegen eines elektrischen Felds bewegen sich die Elektronen in der einen und damit die Löcher in der anderen Richtung. Es fließt somit ein Strom, der allerdings in der Regel sehr klein ist. Diese Form der Leitung in Halbleitern wird als Eigenleitung bezeichnet. Die spezifische Leitfähigkeit von Halbleitern wie Silicium oder Germanium ist um mehrere Größenordnungen geringer als die der Metalle (s. Tabelle).
Für die Herstellung von elektronischen Bauelementen auf der Basis von Halbleitern wie Germanium oder Silicium werden durch Dotierung mit Elementen der 5. Hauptgruppe oder der 3. Hauptgruppe gezielt Überschusselektronen (n-Halbleiter) oder Elektronenlöcher (p-Halbleiter) in das Valenzband eingebracht, um eine bestimmte Leitfähigkeit einzustellen und durch Kombination von n-Leiter-Bereichen und p-Leiter-Bereichen das entsprechende Bauelement zu realisieren.
Die zunehmende Eigenleitfähigkeit des Materials bei höherer Temperatur stört dann aber die gewünschte Funktion des Bauelements und setzt somit dessen obere Temperatur-Einsatzgrenzen fest.
Die Bandlücke zwischen Valenzband und Leitfähigkeitsband ist bei Silicium (Si) mit etwa 1,1 eV größer als bei Germanium (Ge) mit etwa 0,7 eV. Daher treten bei Bauelementen auf Si-Basis erst oberhalb von ca. 150 °C Störungen durch die thermische Eigenleitung auf, während das bei Ge-basierten schon oberhalb 100 °C der Fall ist. Damit wären sie z. B. hinsichtlich der Verwendung in den Tropen gegenüber Si-basierten Bauelementen unterlegen.
| Aluminium | 3,6•107 | Bor | 1,0•10-4 | Glas | 10-11...10-7 |
| Kupfer | 5,9•107 | Germanium | 2,0 | Porzellan | 10-12 |
| Silber | 6,3•107 | Silicium | 2,0•10-4 | Polypropylen | 10-5 |
| Quecksilber | 1,0•106 | Diamant | 10-13 |
-
Metallgitter mit Atomen und frei beweglichen Elektronen