Benzaldehyd
Benzaldehyd ist der einfachste aromatische Aldehyd mit der Summenformel . Es ist eine nach bitteren Mandeln riechende farblose Flüssigkeit. Benzaldehyd ist sehr reaktionsfreudig. Es ist in Ethanol und Ether gut löslich, in Wasser weniger. Durch Autoxidation geht es leicht zu Benzoesäure über. Benzaldehyd ist in bitteren Mandeln und Kernen verschiedener Früchte zu finden, es kann aber auch technisch produziert werden. Verwendet wird es zur Herstellung von parfümierten Seifen, pharmazeutischen Präparaten, speziellen Farbstoffen, sowie Geruchs- und Geschmacksstoffen in Lebensmitteln.
Benzaldehyd – das einfachste aromatische Aldehyd
Benzaldehyd (Formylbenzen) mit der Summenformel ist der einfachste Vertreter der aromatische Aldehyde. Den Grundkörper bildet der Benzenring mit dem aromatischen Elektronensextett. Im Benzaldehyd ist ein Wasserstoffatom des Benzen durch eine Formylgruppe (Aldehydgruppe) substuituiert. Die Aldehyd-Gruppe bestimmt als fuktionelle Gruppe wesentlich die Eigenschaften des Stoffes, wie z. B. die geringe Stabilität (leicht oxidierbar), Flüchtigkeit, Schmelz- und Siedepunkt oder Geruch. Einfluss auf die Eigenschaften der aromatische Aldehyde hat aber auch das zum Carbonyl-Kohlenstoff der Aldehydgruppe benachbarte konjugierte Pi-System der Aromaten, so das sich aromatische Aldehyde von ihren aliphatischen "Verwandten" unterscheiden.
Benzaldehyd ist eine farblose, ölige Flüssigkeit, welche stark Licht brechend ist. Der Geruch ist sehr charakteristisch und erinnert an bittere Mandeln. Es bildet die überwiegende Komponente des Bittermandelöls. Die molare Masse von Benzaldehyd beträgt 106,1 und seine Dichte 1,042 (bei 15°C). Der Schmelzpunkt liegt bei -56 °C, der Siedepunkt bei 178,1 °C. In kleinen Mengen ist Benzaldehyd nicht giftig, da es im Organismus zu Benzoesäure () oxidiert, und als Hippursäure () ausgeschieden wird. Benzaldehyd ist nur wenig in Wasser löslich, mit Ether und Ethanol hingegen ist es beliebig mischbar. Wie alle anderen Aldehyde ist es sehr reaktionsfreudig. In Gegenwart von Schwermetall-Ionen oder Licht oxidiert es an der Luft durch Autoxidation langsam zu Benzoesäure.Bei der Reduktion von Benzaldehyd entsteht Benzylalkohol ().
-
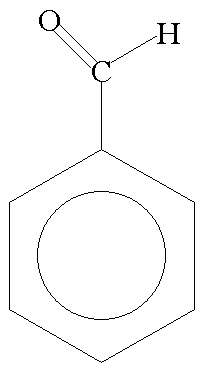
Strukturformel des Benzaldehyds
Vorkommen
Benzaldehyd entsteht bei der Zersetzung des Stoffs Amygdalin, der in bitteren Mandeln enthalten ist. Bei dieser Reaktion bildet sich außerdem Blausäure. Da diese Reaktion auch im Magen stattfindet, ist der Genuss von rohen bitteren Mandeln besonders für Kinder gefährlich. Für Pfirsiche scheint Benzaldehyd ein wachstumshemmender Stoff zu sein. Die sogenannte Pfirsich-Bodenmüdigkeit in Pfirsichplantagen wird auf die Bildung dieses Stoffs zurückgeführt. Außerdem kommt Benzaldehyd, zum größten Teil gebunden, in den Kernen vieler anderer Früchte vor.
Herstellung
Als Edukt für die Synthese von Benzylchlorid im Labor dient Toluen (), welches durch Fotochlorierung zu Benzylidendichlorid (1-(Dichlormethyl)-Benzen, ) auch Benzalchlorid genannt, umgesetzt wird. Mit konzentrierter Schwefelsäure hydrolisiert dieses Dichlorid zu Benzaldehyd. Technisch wird Benzaldehyd durch direkte Oxidation von gasförmigem Toluen, in Gegenwart von Vanadiumpentoxid (), mit Luft bei 300 °C bis 500 °C hergestellt.
Verwendung
Benzaldehyd findet Anwendung bei der Herstellung von Pharmazeutika, Parfümen, Aromastoffen, Triphenylmethan-, und Akridin-Farbstoffen.
Benzaldehyd wird in der Lebensmittelindustrie als Geschmacks- und Geruchsstoff (Aromastoff) eingesetzt. Für Lebensmittelzusätze (Aroma) darf nur chlorfrei synthetisierter Benzaldehyd verwendet werden. Man unterscheidet natürliche (aus entsprechenden pflanzlichen oder tierischen Materialien gewonnene Stoffe), naturidentische (zwar künstlich hergestellte, den natürlichen Vorbildern aber chemisch identische Stoffe) und künstliche (ohne „Vorbilder“ in der Natur) Aromastoffe. Aromastoffe erhalten keine E-Nummern und es besteht keine extra Kennzeichnungspflicht. Als Duftstoff spielt Benzaldehyd besonders in Parfümen mit blumigen Noten (Flieder, Maiglöckchen, Veilchen) eine Rolle.

