Coenzyme und Cofaktoren
Coenzyme und Cofaktoren sind niedrigmolekulare, nichtproteinartige Bestandteile von Enzymen. Coenzyme (latein. cum = zusammen, mit) sind komplexe organische Moleküle (Vitamine, Nucleotide), die meist nur locker oder vorübergehend, seltener kovalent (fest) an den Proteinanteil des Enzyms (Apoenzym) gebunden sind.
Bei Cofaktoren handelt es sich um Metallionen wie die in dieser Form als Elektronenakzeptoren dienen.
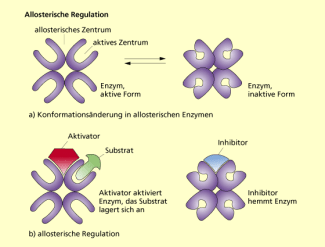
Coenzyme und Cofaktoren bestimmen den Bau und die Wirkung der Enzyme
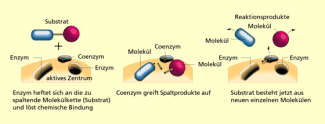
Viele Enzyme sind nur in Anwesenheit von Coenzymen und Cofaktoren aktiv. Coenzyme sind komplexe organische Moleküle, die meist locker oder vorübergehend an den Proteinanteil gebunden sind. Handelt es sich um eine feste Bindung an das Enzym spricht man auch von einer prosthetischen Gruppe. Wie das Enzym, so greift auch das Coenzym in die Reaktion mit dem Substrat ein. Im Gegensatz zu Enzymen werden Coenzyme jedoch durch die Enzymreaktionen, an denen sie beteiligt sind, chemisch verändert, häufig dienen sie als Elektronendonor oder -akzeptor in Redoxreaktionen bzw. als Donor oder Akzeptor in Gruppentransferprozessen. Weil sich die Coenzyme direkt an der Reaktion beteiligen, nennt man sie auch Cosubstrate. Wichtige Cosubstrate sind zum Beispiel Adenosintriphosphat (ATP) oder Nicotinsäureamid-Adenin-Dinucleotid (NAD+).
NAD + ist an biochemischen Redoxreaktionen als Elektronenakzeptor beteiligt. Es übernimmt bei der Oxidation zwei Elektronen und zwei Protonen und wird dabei zu NADH+H+ reduziert. An anderer Stelle können die Elektronen und Protonen wieder abgegeben werden. NADH + H+ wird dabei oxidiert. Nach demselben Mechanismus wie NAD+ wirkt auch Nicotinsäureamid-dinucleotidphosphat (NADP+) als Wasserstoff übertragendes Cosubstrat.In einigen biochemischen Reaktionen wird Wasserstoff auf Flavin-Adenin dinukleotid (FAD) übertragen. Ähnlich wie NAD+ fungiert FAD als zweistufiger Elektronenakzeptor. Ein FAD-Molekül übernimmtin der Summe zwei Elektronen und zwei Protonen und wird über FADH zu FADH2 reduziert.
ATP dient in den Zellen aller Lebewesen als universeller Transport- und Speicherstoff für Energie. Es wird täglich in großer Menge produziert und verbraucht. In den chemischen Bindungen der Triphosphateinheit ist Energie gespeichert, die bei der hydrolytischen Spaltung der Bindungen freigesetzt wird. ATP ist ein wichtiger Energielieferant für enzymatische Reaktion und fungiert daher als Co-enzym bei vielen enzymatischen Reaktionen. Für die Hydrolyse von Adenosintriphosphat zu Adenosindiphosphat und Phosphat sind das ca. 30 kJ pro mol ATP. Da der Körper nicht alle Cofaktoren selber synthetisieren kann, müssen diese oder ihre Vorstufen in Form von Vitaminen mit der Nahrung aufgenommen werden.
Zur Bildung von Coenzymen benötigt die Zelle viele wasserlösliche Vitamine, denn viele heterotrophe Organismen können Coenzyme nicht selber herstellen. Vor allem die Vitamine des Vitamin-B-Komplexes sind Vorstufen von Coenzymen.
Coenzyme und ihre Wirkung
| Vitamin | Coenzym | Abkürzung | Übertragene Gruppe | Funktion |
| Niacinamid | Nico- tinamid- adenindi-nucleotid | Elektronen | Zellatmung, Fettstoff-wechsel | |
| Nico- tinamid-adenindi-nucleotid- phosphat | Elektronen | Fotosynthese | ||
| Riboflavin (Vitamin B2) | Flavi- nadenin- dinucleotid | FAD | Elektronen | Zellatmung |
| Pantothen-säure | Coenzym A | CoA | Acetyl | Zellatmung, Fettstoff-wechsel |
-
-
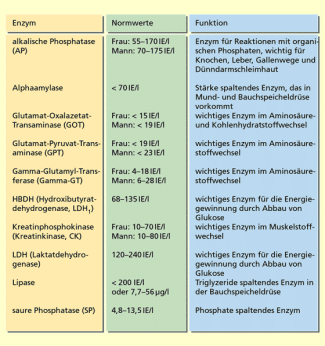
Normwerte und Funktionen ausgewählter Enzyme
Die anorganischen Cofaktoren bilden die Ionen der Metalle Zink, Eisen und Kupfer. Auch sie sind zur Aktivität der entsprechenden Enzyme notwendig. In der Atmungskette übertragen z. B. Eisenionen die Elektronen (Elektronentransportkette):
Ohne die Hilfe der Coenzyme und Cofaktoren treten im Organismus schwerwiegende Stoffwechselstörungen auf. Ausreichende Zufuhr von Vitaminen und Mineralstoffen mit der Nahrung ist deshalb für die Gesundheit des Menschen ungemein wichtig.