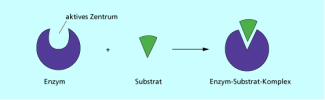
Enzyme
Enzyme sind Biokatalysatoren, die chemische Reaktionen innerhalb eines Organismus beschleunigen. Die meisten Enzyme sind Proteine. Die Wirkung der Enzyme ist in der Regel sehr spezifisch. Zum einen bezieht sich diese Spezifik auf den Reaktionstyp zum anderen auf die Substrate, deren Umsetzung sie katalysieren. Hochspezifische Enzyme setzen nur ein einziges Substrat um (Substratspezifität), andere besitzen eine enge Kopplung an den Reaktionstyp (Wirkungsspezifität), akzeptieren aber eine Vielzahl verschiedener Substrate. Enzyme „erkennen“ ihre Substrate in sehr charakteristischer Weise. Die Ursache dafür liegt im aktiven Zentrum, das den Substraten eines Enzyms angepasst ist.
Bau und Wirkung der Enzyme basieren auf der Schlüssel-Schloss-Theorie
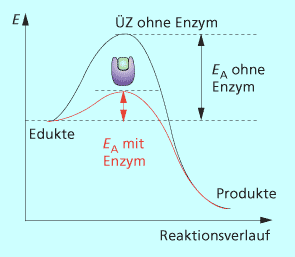
Enzyme sind meist Proteine, die eine spezifische dreidimensionale Struktur besitzen und als Biokatalysatoren wirken. Sie lassen eine Reaktion durch Absenken der Aktivierungsenergie schneller ablaufen, nehmen als typische Katalysatoren jedoch nicht selbst an der Reaktion teil. Im Vergleich zu gewöhnlichen Katalysatoren, die man aus der Chemie kennt, sind Enzyme in der Lage, die Aktivierungsenergie so weit zu senken, dass Reaktionen schon bei Körperwärme sehr schnell ablaufen. Das Temperaturoptimum für die Wirkung von Enzymen des menschlichen Organismus liegt bei 37 °C. Bei höheren Temperaturen verlieren sie ihre Aktivität aufgrund der für Eiweiße charakteristischen Zerstörung der Tertiärstruktur (Denaturierung). Es gibt jedoch auch einige wenige Ausnahmen. 1975 wurde das Eubakterium Thermophilus aquaticus entdeckt, das sich bei 80° C am wohlsten fühlt. Dessen DNA-Polymerase wurde isoliert und wird wegen seiner Thermostbilität in Labors für PCR (eine Technik zur Vervielfältigung von DNA) genutzt.
Enzyme wirken mit hoher Spezifität. Sie erkennen nur ein ganz bestimmtes Substrat (Substratspezifität). In Abhängigkeit von den Eigenschaften des aktiven Zentrums katalysiert ein bestimmtes Enzym nicht jede beliebige Reaktion sondern setzt das Substrat zu ganz bestimmten Produkten um. Diese Eigenschaft nennt man Wirkungsspezifität.
Enzyme sind Biokatalysatoren, welche wie Katalysatoren generell nicht an der Reaktion, die sie beschleunigen, teilnehmen. Im Vergleich zu anderen Katalysatoren wirken Enzyme mit hoher Spezifität. Ein bestimmtes Enzym katalysiert nicht jede beliebige Reaktion sondern setzt nur ganz bestimmte Substrate zu ganz bestimmten Produkten um. Diese Eigenschaft nennt man Substratspezifität. Wie erkennt ein Enzym „sein“ Substrat?
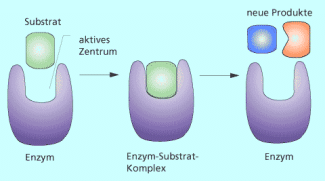
Die Erkennung des bestimmten Substrats geschieht nach dem Schlüssel-Schloss-Prinzip, welches von EMIL HERMANN FISCHER (1852-1919) 1894 entdeckt wurde. Das aktive Zentrum des Enzyms ist vorgeformt, so dass ein Substrat nur in einer ganz bestimmten Orientierung binden kann. Die Schlüssel-Schloss-Theorie geht vom Zusammenpassen von Molekülen aufgrund ihres komplementären Baus aus. Enzym und Substrat passen zusammen wie der Schlüssel zu einem Schloss. Die Substratbindung wird also ermöglicht, weil die Gestalt des aktiven Zentrums komplementär zu einer Stelle im Substrat passt. Die aktiven Zentren werden oft von funktionellen Gruppen benachbarter Aminosäuren des Peptids gebildet. Diese sind häufig um Metallionen koordiniert (Mg, Zn, Fe), wodurch die spezifische Geometrie des Zentrums gebildet wird. Weiterhin können auch intermediär gebundene Coenzyme die Struktur des aktiven Zentrums beeinflussen.
Dieser bildliche Ausdruck hat sich als sehr fruchtbar für die Enzymforschung erwiesen. Er erklärt auf einfache Weise die Substratspezifik der Enzyme. 1958 wurde das Modell von DANIEL E. KOSHLAND JR. weiterentwickelt. Er fand heraus, dass das aktive Zentrum vieler Enzyme erst nach der Bindung mit dem Substrat eine dazu komplementäre Form annimmt. Im dynamischen Prozess erkennt das Enzym das Substrat und passt die Gestalt des aktiven Zentrums an (Induced-Fit). Das Induced-Fit-Modell ist die modernere, mehr zutreffende Theorie.
-
Energetischer Verlauf einer Enzymreaktion: Mittels der Saccharase (Enzym) wird Saccharose und Wasser in sekundenschnelle zu Glucose und Fructose hydrolysiert.
-
Das Schlüssel-Schloss-Prinzip bedingt die Substratspezifität von Enzymen.
-
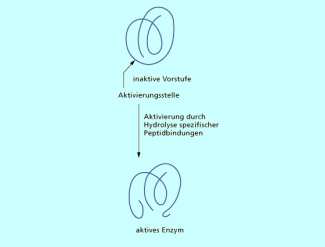
Aktivierung eines Enzyms
-
Dynamisches Induced-Fit-Modell zur Erkennung des Substrats durch das Enzym