Die Chalkogene (6. Hauptgruppe ) – Eigenschaften und wichtige Verbindungen
Die Elemente der 6. Hauptgruppe werden auch als Chalkogene (Erzbildner) bezeichnet; zu ihnen gehören Sauerstoff, Schwefel, Selen, Tellur und Polonium. Während Sauerstoff und Schwefel Nichtmetalle sind, erhöht sich der Metallcharakter mit steigender Ordnungszahl. Polonium ist ein radioaktives Metall.
Sauerstoff ist ein wichtiger Bestandteil der Luft.
Gruppeneigenschaften
Die Elemente der 6. Hauptgruppe werden auch als Chalkogene (Erzbildner) bezeichnet. Zu ihnen gehören Sauerstoff (O), Schwefel (S), Selen (Se), Tellur (Te) und Polonium (Po). Die Chalkogene besitzen sechs Außenelektronen, sie müssen also zwei Elektronen aufnehmen bzw. zwei Atombindungen ausbilden, um Edelgaskonfiguration mit acht Außenelektronen zu erreichen. Die Elemente Schwefel, Selen und Tellur können allerdings bis zu sechs Atombindungen schließen, für sie gilt die Oktettregel nicht streng.
Der Metallcharakter der Chalkogene nimmt innerhalb der Gruppe von oben nach unten zu. Sauerstoff und Schwefel sind typische Nichtmetalle, Selen und Tellur besitzen in einigen Modifikationen Halbleitereigenschaften und zählen deshalb zu den Halbmetallen. Chemisch gesehen reagieren sie aber vorwiegend wie Nichtmetalle. Polonium hingegen ist ein radioaktives Metall. Die Schmelz- und Siedepunkte der Chalkogene nehmen mit steigender Ordnungszahl zu. Sauerstoff ist gasförmig, die anderen Elemente sind fest. Die Elektronegativitätswerte nehmen mit steigender Ordnungszahl ab.
Eigenschaften der einzelnen Elemente
Sauerstoff
Sauerstoff ist ein farbloses und geruchloses Gas, das aus zweiatomigen Molekülen besteht. In den Molekülen sind die beiden Sauerstoffatome durch zwei Atombindungen miteinander verbunden. Da die Doppelbindung relativ stabil ist, erfolgen Reaktionen mit Sauerstoff (Oxidationen) meist erst bei höheren Temperaturen.
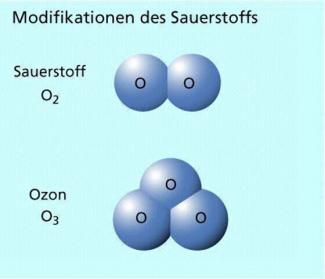
Eine zweite Modifikation des Sauerstoffs ist das Ozon , das aus gewinkelten -Molekülen besteht.
Ozon ist ebenfalls ein Gas, sein Schmelz- und Siedepunkt liegen aber höher als der von . Es besitzt einen charakteristischen Geruch, den man z. B. gut in Copyshops wahrnehmen kann.
Die Bildung von Ozon aus Sauerstoff ist endotherm. Es entsteht z. B. in der Stratosphäre durch Fotolyse von molekularem Sauerstoff. Dabei spaltet die energiereiche UV-Strahlung der Sonne die Sauerstoffmoleküle in Atome, die mit weiteren Sauerstoffmolekülen Ozon bilden. Da die Spaltung durch Einwirkung von Strahlung angeregt wird, spricht man auch von fotochemischer Reaktion.
Das fotochemisch gebildete Ozon wird ebenfalls durch Strahlung unter Rückbildung von molekularem Sauerstoff wieder gespalten.
Zwischen Ozonbildung und -zerfall stellt sich ein Gleichgewicht und folglich eine ständige Ozonschicht in der Stratosphäre ein. Diese Ozonschicht absorbiert UV-Strahlung und verhindert, dass der biologisch schädliche Teil dieser Strahlung λ < 300 nm auf die Erdoberfläche gelangt; es ist damit notwendig für das Leben auf der Erde.
In Bodennähe führen Autoabgase im Sommer zur Bildung von Ozon, das wesentlichen Anteil am Sommersmog hat. Hier ist es nicht erwünscht, weil es Augen und Schleimhäute reizt und die Atmungsorgane schädigt.
-
Modifikationen des Sauerstoffs
Schwefel
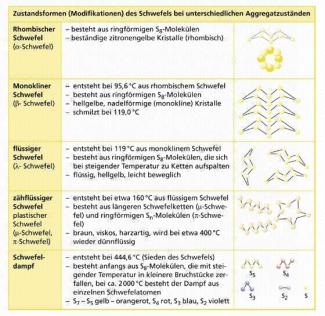
Schwefel ist ein gelber Feststoff (Bild 3). Er besitzt die Tendenz, Ketten oder Ringe zu bilden. Die zahlreichen Modifikationen des Schwefels basieren auf den verschiedenen Molekülgrößen und deren unterschiedlichen Anordnungen. Die bei Standardbedingungen stabile Modifikation ist rhombischer Schwefel (), der aus -Ringen besteht und von der Seite betrachtet wie eine Krone aussieht (Kronenschwefel, Cyclooctaschwefel).
Cyclooctaschwefel ist bei Raumtemperatur wenig reaktionsfähig. Bei höheren Temperaturen reagiert er jedoch direkt mit vielen Metallen und Nichtmetallen.
-
Modifikationen des Schwefels
Selen, Tellur und Polonium
Von Selen gibt es ebenfalls verschiedene Modifikationen. Im roten Selen liegen -Ringe vor. Wenn man es erhitzt, wandelt es sich bei ca. 100 °C in das sogenannte graue Selen, die stabilste Modifikation, um. Graues Selen hat Halbleitereigenschaften. Es ist ein Fotohalbleiter , d. h. seine Leitfähigkeit wird durch Licht verstärkt.
Tellur kommt in zwei Modifikationen vor, von denen nur eine stabil ist. Die stabile Modifikation ist silberweiß-metallisch, sehr spröde und wie Selen ein Halbleiter. Die zweite Modifikation, braunes pulvriges Tellur, wandelt sich schon bei Raumtemperatur in silberweißes Tellur um.
Polonium ist radioaktives Metall und kommt in mehreren Zerfallsreihen vor. Das am häufigsten vorkommende natürliche Isotop hat eine Halbwertzeit von 138,4 Tagen.
Verwendung der Elemente
Schwefel wird hauptsächlich zur Herstellung von Schwefelsäure (>85 %), außerdem zum Vulkanisieren von Kautschuk, zur Herstellung von Zündhölzern, Feuerwerkskörpern und Schießpulvern eingesetzt.
Graues Selen ist ein Halbleiter, dessen Leitfähigkeit durch Licht verstärkt wird. Es findet z. B. Anwendung in Belichtungsmessern in Fotoapparaten und Videokameras und in Fotokopierern.
Tellur wird als Legierungsbestandteil verwendet.
Polonium wird in der Strahlenchemie und -biologie als und in Satelliten als Wärmequelle genutzt.
Vorkommen und Gewinnung
Sauerstoff kommt elementar in der Luft vor (21 Vol.-%). Außerdem ist Sauerstoff in vielen chemischen Verbindungen wie in Silicaten, Carbonaten und Oxiden und im Wasser enthalten. Es ist das häufigste Element in der Erdkruste.
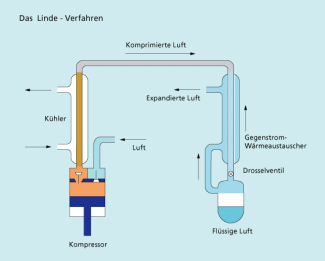
Gewonnen wird reiner Sauerstoff aus der Luft seit 1905 nach dem LINDE-Verfahren (Bild 6). Dieses Verfahren basiert auf der fraktionierten Destillation von verflüssigter Luft. Bei der Gewinnung des Sauerstoffs werden auch die in der Luft enthaltenen Edelgase isoliert.
Beim LINDE-Verfahren wird die Luft auf 200 bar komprimiert und die dabei entstehende Wärme durch Kühlen abgeführt. Über ein Drosselventil wird dann die Luft entspannt, wobei sie sich infolge der dabei geleisteten Arbeit abkühlt (JOULE-THOMSON-Effekt). Der Prozess wird wiederholt, bis die Luft kondensiert, d. h. vom gasförmigen in den flüssigen Zustand übergeht.
Schwefel kommt in der Natur elementar in größeren Lagerstätten vor. Außerdem sind Sulfide und Sulfate von Bedeutung für die technische Gewinnung von Schwefel.
Wichtige Mineralien sind z. B. Pyrit (), Zinkblende (ZnS), Bleiglanz (PbS), Zinnober (HgS) und Gips ()
-
Linde-Verfahren (schematisch)
Ca. 20 % der Weltproduktion des Schwefels werden nach dem FRASCH-Verfahren aus den elementaren Vorkommen gewonnen. Dabei wird mit heißem Wasserdampf der Schwefel unter Tage geschmolzen und mit Druckluft an die Erdoberfläche gepresst. Der dabei geförderte Schwefel ist bereits sehr rein (99,5 - 99,9 %).
Die Hauptmenge des Schwefels wird heute nach dem CLAUS-Prozess aus -haltigen Gasen (Erdgas, Raffineriegas) hergestellt. Dabei wird zuerst ein Teil des Schwefelwasserstoffs zu Wasserdampf und Schwefeldioxid verbrannt:
Die Sauerstoffzufuhr muss so eingestellt werden, dass nur die Hälfte des Schwefelwasserstoffs zu Schwefeldioxid umgesetzt wird, sodass in der nachgeschalteten Reaktorzelle ein - Verhältnis von 2:1 vorliegt. Dabei entsteht dann elementarer Schwefel.
Selen und Tellur sind als Selenide und Telluride spurenweise in den sulfidischen Erzen vorhanden. Mineralien von Selen und Tellur sind sehr selten. Tellur kommt ganz selten sogar gediegen vor. Beim Rösten von sulfidischen Erzen entstehen auch Selendioxid und Tellurdioxid, aus denen die Elemente erhalten werden können. Außerdem werden sie aus dem Anodenschlamm gewonnen, der bei der elektrolytischen Kupferraffination entsteht.
Wichtige Verbindungen
Sauerstoffverbindungen
Die wichtigste Verbindung des Sauerstoffs ist das Wasser . Es ist eine der beständigsten Verbindungen der Erde. Selbst bei 2 000 °C sind nur 2 % der Wassermoleküle in die Elemente gespalten. Das Wasservolumen der Erde beträgt etwa , was einem Würfel von 1 100 km Kantenlänge entspricht.
Eine zweite Verbindung des Sauerstoffs mit Wasserstoff ist das Wasserstoffperoxid .
Es ist eine farblose, in dicker Schicht bläulich erscheinende sirupartige Flüssigkeit mit einem Siedepunkt von 150 °C. Handelsüblich ist eine 30% ige Lösung („Perhydrol“). Die O-O Bindung im Wasserstoffperoxid ist schwach. Deshalb zersetzt es sich bei höheren Temperaturen oder in Anwesenheit von Schwermetall-Ionen, eventuell auch explosionsartig.
Verwendet wird Wasserstoffperoxid als Desinfektionsmittel und als Bleichmittel.
Schwefelverbindungen
Mit Wasserstoff bildet Schwefel Schwefelwasserstoff H2S, ein giftiges, übel nach faulen Eiern riechendes Gas. Es entsteht u. a. neben Methan bei Fäulnisprozessen. Die Salze des Schwefelwasserstoffs sind die Sulfide (Anion ) und die Hydrogensulfide (Anion ).
-
Strukturformeln wichtiger Schwefelverbindungen
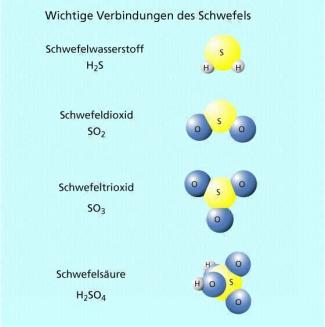
Schwefel bildet mit Sauerstoff verschiedene Oxide. Die wichtigsten sind Schwefeldioxid () und Schwefeltrioxid ().
Schwefeldioxid ist ein farbloses, stechend riechendes Gas mit einem Siedepunkt von -10 °C, das stark reduzierend wirkt. Es löst sich in Wasser, wobei Schweflige Säure gebildet wird. Viele Farbstoffe werden durch Schwefeldioxid entfärbt (Bild 9).
Schwefeldioxid wird technisch durch die Verbrennung von Schwefel hergestellt. Außerdem entsteht es beim Rösten von sulfidischen Erzen an der Luft:
Das Schwefeldioxid wird vorrangig zu Schwefelsäure verarbeitet. Schwefeltrioxid ist das Anhydrid der Schwefelsäure, das bei der katalytischen Oxidation von entsteht.
Leitet man Schwefeltrioxid in Wasser ein, so entsteht Schwefelsäure.
Schwefelsäure
Schwefelsäure hat in der Industrie große Bedeutung. Sie dient hauptsächlich zur Produktion von Düngemitteln, außerdem wird sie z. B. zur Herstellung von Tensiden, Farbstoffen und Chemiefasern verwendet. Weil sie Wasser entziehend wirkt, wird sie auch als Trockenmittel eingesetzt.
Reine Schwefelsäure ist eine farblose ölige Flüssigkeit. Sie ist eine starke Säure. Mit Wasser ist sie in jedem Verhältnis mischbar. Die Reaktion mit Wasser ist stark exotherm, weshalb insbesondere hier der Spruch gilt: „Erst das Wasser dann die Säure, sonst passiert das Ungeheure.“ Durch die entstehende Wärme verdampft das Wasser schlagartig und reißt dabei Schwefelsäuretröpfchen mit.
Sulfate
Die Salze der Schwefelsäure, die Sulfate , kommen häufig in der Natur vor, z. B. Calciumsulfat (Anhydrit, Gips) und Bariumsulfat (Schwerspat).
Calciumsulfat hat je nach der Menge des eingelagertem Kristallwassers unterschiedliche Namen und Eigenschaften. Wasserfreies Calciumsulfat wird Anhydrit genannt. Das Hemihydrat wird „gebrannter Gips“ genannt und dient als Baustoff. Mit Wasser reagiert gebrannter Gips unter Volumenzunahme zum Dihydrat , das auch Gips genannt wird. Diese Volumenzunahme ermöglicht die Anfertigung von Gipsformen, die feinste Strukturen wiedergeben, denn sie bewirkt, dass Gips in die kleinsten Ausbuchtungen gedrückt wird.
-
Stuck aus Gips

Bariumsulfat ist ein schwer lösliches, chemisch beständiges Salz. Es wird als Weißpigment (Permanentweiß) z. B. in Malerfarben verwendet und dient als Füllstoff bei der Produktion von Papier und Gummi. Außerdem wird es als Kontrastmittel bei Röntgenuntersuchungen eingesetzt. Hierfür darf es keine Spuren von löslichen Bariumverbindungen enthalten, da diese giftig sind.
Natriumsulfat (Glaubersalz) wird in der Glas-, Textil- und Papierindustrie verwendet. Außerdem wird es in der Medizin als Abführmittel eingesetzt.
Verbindungen von Selen und Tellur
Die Verbindungen von Selen und Tellur ähneln im Allgemeinen den entsprechenden Schwefelverbindungen, wobei die Ähnlichkeit bei Selen stärker ausgeprägt ist als bei Tellur.
Wie Schwefelwasserstoff sind auch Selen- und Tellurwasserstoff farblose, sehr giftige und unangenehm riechende Gase.
Selen und Tellur verbrennen an der Luft zu farblosen Dioxiden (, ). Auch die Trioxide (, ) sind bekannt.
Beim Lösen von Selendioxid in Wasser entsteht Selenige Säure , aus der durch Oxidation z. B. mit Selensäure hergestellt werden kann.
Die Tellursäure hat die Formel und weicht aufgrund der Größe des Telluratoms in ihrer Summenformel und ihrem Bau von ihren „Verwandten“, der Schwefelsäure und der Selensäure ab. Ein Telluratom ist oktaedrisch von sechs OH Gruppen umgeben. Die Tellursäure ist also eine sechswertige Säure.
Suche nach passenden Schlagwörtern
- Fotohalbleiter
- Schwefeldioxid
- Tellur
- Claus-Verfahren
- Schwefelwasserstoff
- Selen
- 6. Hauptgruppe
- Photohalbleiter
- Linde-Verfahren
- Schwefelsäure
- Lindeverfahren
- Fraschverfahren
- sechste Hauptgruppe
- Schweflige Säure
- Ozon
- Claus-Prozess
- Schwefeltrioxid
- Sauerstoff
- Polonium
- Wasser
- Chalkogene
- Wasserstoffperoxid
- Schwefel
- Frasch-Verfahren

