Elektrolyse
Die beim Stromdurchgang durch einen Elektrolyten hervorgerufenen chemischen Veränderungen werden als Elektrolyse bezeichnet. Es erfolgt die direkte Umwandlung elektrischer Energie in chemische Energie.
Elektrolytische Prozesse sind elektrochemische Reaktionen, bei denen nicht freiwillig ablaufende Stoffumwandlungsprozesse durch Anlegen einer äußeren Spannung erzwungen werden. Elektrische Energie (Strom) wird in chemische Energie (Stoffe) umgewandelt.
Die Elektrolyse ist die Umkehrung galvanischer Prozesse durch Verrichten elektrischer Arbeit. So kann Wasser elektrolysiert werden, indem man zwei Platinelektroden in verdünnte Schwefelsäure oder Kalilauge taucht und von außen eine entsprechende Mindestspannung anlegt.
Anode: 4 OH- (aq) –→ 2 H2O(l) + O2(g) + 4 e-
Katode: 4 H2O(l) + 4 e- –→ 4 OH- (aq) + 2 H2(g)
Gesamt: 2 H2O(l) –→ 2 H2(g) + O2(g)
Die Mindestspannung, die aufgebracht werden muss, um die elektrolytische Reaktion in Gang zu bringen, nennt man theoretische Zersetzungsspannung. Sie ergibt sich aus der Differenz der Elektrodenpotenziale des katodischen und anodischen Prozesses.
Unter Standardbedingungen muss für die Elektrolyse von Wasser theoretisch eine Zersetzungsspannung von 1,23 V angelegt werden. In der Praxis stellt man jedoch fest, dass die elektrolytische Zersetzung erst bei einer höheren Spannung als 1,23 V erfolgt. Das hat u. a. damit zu tun, dass die Elektroden und der Elektrolyt einen ohmschen Widerstand aufweisen, der zum Spannungsabfall durch die sogenannte Badspannung führt. Noch gravierender wirkt sich die Tatsache aus, dass die Elektrodenpotenziale im stromdurchflossenen Zustand bei der Elektrolyse nicht identisch sind mit den nach der nernstschen Gleichung bestimmbaren Potenzialen im stromlosen Zustand.
Die Differenz zwischen dem Elektrodenpotenzial bei Stromfluss und dem Gleichgewichtselektrodenpotenzial der nernstschen Gleichung bezeichnet man als Überspannung η.
η = EStromfluss - E(I = 0)
Die Überspannung bei elektrolytischen Prozessen hat in erster Linie kinetische Ursachen und hängt von vielen Faktoren, z. B. dem Elektrodenmaterial, ab. Die praktische notwendige Zersetzungsspannung UZers setzt sich also aus drei Komponenten zusammen:
Speziell Elektrolysen, bei denen Gase als Reaktionsprodukte entstehen, weisen oftmals sehr hohe Überspannungen auf. Bei der Wasserelektrolyse kann die Überspannung je nach Stromfluss und Elektrodenmaterial bis zu 2 V betragen. Somit müssen viel größere Zersetzungsspannungen angelegt werden, als man über die entsprechenden nernstschen Gleichungen aus den jeweiligen Elektrodenpotenzialen berechnet. Für Wasserstoff beträgt die Überspannung an Platin nur 0,02 V, an Quecksilber hingegen 1,0 V.
Faradaysche Gesetze
Der bei der Elektrolyse durch die Elektroden fließende Strom ist direkt mit dem chemischen Stoffumsatz verbunden. Die quantitativen Beziehungen zwischen der geflossenen Ladungsmenge und den umgesetzten Produkten leitete MICHAEL FARADAY (1791-1867) in den Jahren 1833/34 ab.
1. faradaysches Gesetz
Die Stoffmenge eines Reaktionsprodukts n(B) ist proportional zur geflossenen Ladungsmenge Q:
I – Stromstärke
t – Zeit
z – Elektronenanzahl
F – Faraday-Konstante
Die Faraday-Konstante F verbindet die Elementarladung mit der Stoffmenge:
e- – Elementarladung
NA – Avogadro-Konstante
F = 96 485 A· s · mol-1
Verdoppelt man die Stromstärke I oder die Zeit t, so scheidet sich auch die doppelte Menge des Stoffs B ab. Auf Grundlage des 1. faradayschen Gesetzes kann man die geflossene Ladungsmenge über die Masse eines elektrolytisch abgeschiedenen Stoffs bestimmen.
2. faradaysches Gesetz
Die Massen von durch gleiche Ladungsmengen abgeschiedenen Stoffen verhalten sich zueinander wie die Quotienten aus Molmassen und ausgetauschten Elektronen.
Demzufolge hängt die an einer Elektrode umgesetzte Stoffmenge bei konstanter zur Verfügung stehender Ladung ausschließlich von der Anzahl der ausgetauschten Elektronen ab. So werden bei einer geflossenen Ladung von 96 485 C genau 1 mol Silber (z = 1) bzw. 0,5 mol Zink (z = 2) bzw. 0,25 mol Disauerstoff (z = 4) elektrolytisch abgeschieden.
Die faradayschen Gesetze stellen den quantitativen Zusammenhang zwischen der elektrischen Ladung und dem elektrochemischen Stoffumsatz her. Sie wirken unabhängig von der chemischen Natur des elektrolytisch abgeschiedenen Stoffs.
-
Aufbau einer Elektrolyseapparatur
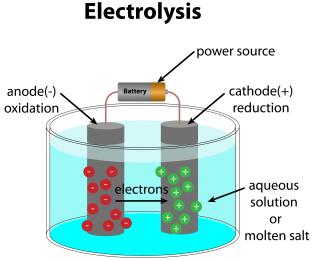
gstraub - shutterstrock
Anwendungen von Elektrolyseprozessen
Bei der Anwendung elektrolytischer Prozesse in Wissenschaft und Technik haben sich drei Haupteinsatzgebiete herauskristallisiert:
- industrielle Synthesverfahren von Elementen und Verbindungen,
- elektrochemische Analyseverfahren,
- Korrosionsschutz durch Elektrolyse.
Großtechnische Synthesen durch Elektrolyse
Mittels elektrolytischer Verfahren werden Stoffe hergestellt, die durch chemische Redoxreaktionen nicht oder nur sehr aufwendig gewonnen werden könnten. Dabei unterscheidet man grundsätzlich zwischen der Elektrolyse in wässrigen Lösungen und der Schmelzflusselektrolyse.
Die Elektrolyse aus wässrigen Lösungen ist zwar energetisch weniger aufwendig, kann aber nur durchgeführt werden, wenn das tatsächliche Abscheidepotenzial des gewünschten Elektrolyseprodukts kleiner ist als das Abscheidepotenzial von Wasserstoff bzw. Sauerstoff aus der jeweiligen Elektrolytlösung.
| Verfahren | Produkte | Bedeutung |
| Chloralkali-Elektrolyse | Chlor und Natronlauge | wichtige Grundstoffe der chemischen Industrie |
| Schmelzflusselektrolyse von Aluminium | Aluminium als Gebrauchsmaterial | zweitwichtigstes Metall nach Eisen, z. B. im Fahrzeug- und Flugzeugbau |
| Elektroraffination von Kupfer | Kupfer als Hauptprodukt und SIlber, Gold, Platin als Nebenprodukte | Herstellung von hochreinem Kupfer, z. B. für die Elektroindustrie |
| Herstellung organischer Verbindungen | z. B. Anilin aus Nitrobenzen | Synthese chemisch schwer zugänglicher Verbindungen |
| Galvanisieren | Metallische Überzüge | Korrosionsschutz, verbessertes Aussehen |
Bei der elektrolytischen Raffination von Metallen wie Kupfer wird das Rohkupfer anodisch aufgelöst und dann als Reinstkupfer katodisch wieder abgeschieden. Die edleren Verunreinigungen im Rohkupfer wie Silber werden unter den gewählten Bedingungen nicht oxidiert und fallen als sogenannter Anodenschlamm an. Unedlere Verunreinigungen wie Zink gehen zwar mit in Lösung, werden aber an der Katode nicht mit abgeschieden, da sie ein höheres Abscheidepotenzial haben.
Elektrolysen werden zunehmend zur Herstellung anorganischer und organischer Verbindungen, wie z. B. Wasserstoffperoxid, genutzt.
Elektrochemische Analysemethoden
Elektrochemische Prozesse bilden die Grundlage für viele qualitative und quantitative Analysemethoden.
Durch Elektrogravimetrie kann z. B. der Kupfergehalt wässriger Lösungen sehr genau bestimmt werden. Cu2+-Ionen werden dabei so lange an der Katode abgeschieden, bis ein Anstieg der notwendigen Gleichspannung anzeigt, dass keine Cu2+-Ionen mehr im Elektrolyten vorliegen. Durch Wägung der Katode kann die Masse an Kupfer in der Probelösung direkt ermittelt werden.
Korrosionsschutz durch Elektrolyse
Galvanisieren ist die elektrolytische Herstellung metallischer Überzüge auf anderen Werkstoffen, meistens Metallen.
Das Galvanisieren ist trotz seines Namens ein elektrolytischer Prozess. Ein Beispiel ist die Verchromung eisenhaltiger Metalle aus saurer Dichromatlösung. Aufgrund seiner guten Luft- und Feuchtigkeitsbeständigkeit wird Chrom für rostschützende Überzüge von Eisenteilen von Kraftfahrzeugen und Fahrrädern, aber auch für Wasserhähne und Armaturen im Sanitärbereich verwendet.
Als Elektrolyt bei Verchromungen dient eine Chromsäurelösung, der Chrom(III)-sulfat und Schwefelsäure zugesetzt werden. Das zu verchromende Metallteil wird dann als Katode geschaltet, an der Cr3+-Ionen zu metallischem Chrom reduziert werden und eine bis zu 500 µm dicke, optisch attraktive Korrosionsschicht bilden.
Bei sorgfältiger Vorbehandlung der Metallteile ist es möglich, eine ca. 5 µm dünne Zinkschicht auf ganze Autokarosserien oder andere große Metallteile zu bringen. Der Korrosionsschutz durch unedlere Metalle wie Zink ist sehr dauerhaft, weil diese zum einen dichte, korrosionsbeständige Metalloxidschichten bilden. Zum anderen entsteht bei kleinen Beschädigungen ein Lokalelement, an dem das unedlere Metall (E 0(Zn/Zn2+) = -0,76 V) oxidiert wird und nicht das edlere Eisen (E 0(Fe/Fe2+) = -0,41 V). Bei einer Beschichtung mit edleren Metallen wie Zinn (E 0(Sn/Sn2+) = -0,14 V) fungiert Eisen dagegen als Lokalanode und die Korrosion schreitet deutlich schneller voran als bei verzinkten Eisenteilen.
-
Elektrolyse: Mit dem Transport von Ladung ist ein Stofftransport verbunden.
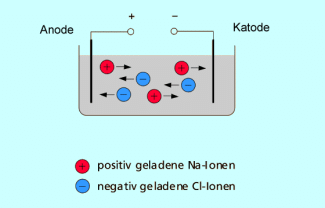
-
Der Korrosionsschutz durch unedlere Metalle wie Zink (rechts) ist sehr dauerhaft; Zink fungiert als Lokalelement und wird statt des Eisens oxidiert. Bei einer Beschichtung mit edleren Metallen wie Zinn (links) fungiert dagegen Eisen als Lokalanode, sodass die Korrosion deutlich schneller voranschreitet..


