Elemente der 2. Hauptgruppe (Erdalkalimetalle) – Eigenschaften und wichtige Verbindungen
Zur 2. Hauptgruppe, den Erdalkalimetallen, gehören die Elemente Beryllium, Magnesium, Calcium, Strontium, Barium und Radium. Sie sind alle Leichtmetalle. Die Reaktivität der Erdalkalimetalle nimmt mit steigender Ordnungszahl deutlich zu. Die Leichtmetalle sind zweiwertig und liegen (außer Be) als zweifach positive Kationen in den Verbindungen vor.
Magnesium und Calcium gehören zu den 10 häufigsten Elementen der Erdkruste.
Eigenschaften der Elemente
Die Elemente der 2. Hauptgruppe werden auch als Erdalkalimetalle bezeichnet. Zu ihnen gehören Beryllium (Be), Magnesium (Mg), Calcium (Ca), Strontium (Sr), Barium (Ba) und Radium (Ra). Sie besitzen zwei Elektronen in der äußeren Schale.
Die Erdalkalimetalle haben viele Gemeinsamkeiten. Sie sind alle, wie der Gruppenname nahelegt, Metalle. Da ihre Dichten unter 4,5 g/cm³ liegen, handelt es sich um Leichtmetalle . Außerdem sind sie weich und daher leicht verformbar. Nur Beryllium fällt aus der Reihe: Es ist spröde und hart und besitzt einen deutlich höheren Schmelz- und Siedepunkt als die übrigen Elemente der 2. Hauptgruppe.
Edelgaskonfiguration erreichen die Erdalkalimetalle, indem sie ihre beiden Außenelektronen abgeben. Im Vergleich zu den Alkalimetallen sind sie jedoch weniger reaktiv, weil es eine höhere Ionisierungsenergie erfordert, zwei Außenelektronen abzuspalten als eins wie bei den Alkalimetallen. Dies lässt sich damit begründen, dass die Erdalkalimetalle eine höhere Kernladung und somit entsprechend kleinere Atomradien aufweisen als die Alkalimetalle.
Innerhalb der Gruppe nimmt die Reaktivität von oben nach unten zu, weil zwischen den Außenelektronen und dem Atomkern immer mehr volle Elektronenschalen liegen und so der Abstand der Außenelektronen zum Kern immer größer wird. Daraus ergibt sich, dass diese vom Atomkern weniger stark angezogen werden und somit leichter abgespalten werden können.
Die Erdalkalimetalle geben leicht ihre beiden Außenelektronen ab, wobei zweifach positiv geladene Ionen entstehen, und sind daher unedle Metalle, die an der Luft oxidiert werden. Beryllium und Magnesium bilden aber stabile Oxidschichten aus und werden dadurch passiviert, d. h. nur ihre Oberfläche wird oxidiert. Diese Passivierung bewirkt auch, dass Wasser Beryllium und Magnesium nur langsam angreift. Calcium, Strontium und Barium hingegen reagieren mit Wasser zu den Hydroxiden, wobei Wasserstoff entsteht. Wie die Alkalimetalle, so sind also auch die Erdalkalimetalle Basenbildner.
Ansonsten reagieren die Erdalkalimetalle gut mit Nichtmetallen, z. B. mit Sauerstoff oder mit den Halogenen.
Mit Säuren bilden sie ebenfalls Verbindungen, die zum Teil von großer wirtschaftlicher Bedeutung sind. Wichtige Verbindungen sind beispielsweise Calciumcarbonat (Kalkstein) und Calciumsulfat (Gips).
Die Wasserlöslichkeit der Erdalkaliverbindungen ist sehr unterschiedlich. So löst sich z. B. Calciumchlorid sehr gut in Wasser, Calciumcarbonat hingegen kaum.
Verwendung der Elemente
Magnesium und Calcium haben von den Elementen der 2. Hauptgruppe die größte Bedeutung.
Technisch besitzt Magnesium große Bedeutung als Bestandteil von über 300 Legierungen mit mehr als 20 Metallen. Wegen ihrer geringen Dichte sind diese für den Fahr- und Flugzeugbau geeignet. Legierungen mit einem Anteil von über 90% Magnesium und Zusätzen von Aluminium, Mangan, Zink oder Kupfer besitzen eine besonders geringe Dichte und hohe chemische Resistenz gegen Fluss-Säure, Alkalien sowie gegenüber Luftfeuchtigkeit. Calcium hat als Legierungsbestandteil eine geringere Bedeutung.
Zusätze von Beryllium zu Kupfer erhöhen die Härte, die Korrosionsbeständigkeit und die Bruchfestigkeit enorm. Diese Legierungen werden daher für stark beanspruchte Motorteile sowie für abriebfeste Bauteile verwendet.
Strontium und Barium haben keine besondere Bedeutung für technische Anwendungen.
Alle Isotope des Radiums sind radioaktiv, weswegen es technisch nicht verwendet wird. Das langlebigste Isotop hat eine Halbwertszeit von 1 600 Jahren.
Vorkommen und Gewinnung
Beryllium gehört zu den seltenen Elementen und kommt u. a. im Mineral Beryll vor. Vom Beryll ist übrigens unser Wort Brille abgeleitet, denn die ersten Brillen wurden aus diesem Material hergestellt. Auch bei den Edelsteinen Smaragd und Aquamarin handelt es sich um Beryll, der Chrom bzw. Eisen enthält.
Magnesium ist das achthäufigste Element der Erdkruste, es ist als Magnesit , Dolomit sowie in Silicaten weit verbreitet.
Die großtechnische Darstellung erfolgt durch Schmelzflusselektrolyse von Magnesiumchlorid.
Calcium ist noch häufiger als Magnesium und findet sich in riesigeren Vorkommen als Kalk (), Dolomit oder Gips () bzw. Anhydrit ().
Die technische Herstellung von elementarem Calcium erfolgt aluminothermisch, d. h. durch Reduktion von Calciumoxid mit Aluminium:
Strontium und Barium kommen häufig als Carbonate oder als Sulfate vor.
Durch Schmelzflusselektrolyse von Strontiumchlorid im Gemisch mit Strontiumfluorid oder Kaliumchlorid kann elementares Strontium gewonnen werden.
Barium wird wie Calcium aluminothermisch hergestellt:
-
Häufigkeit der Elemente in der Erdkruste
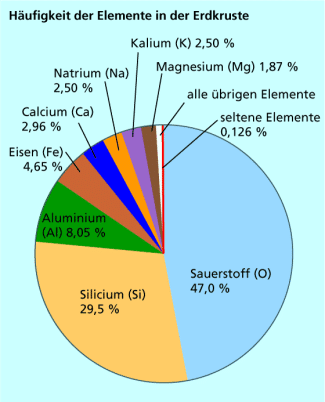
Erwähnt werden muss die biologische Bedeutung von Calcium und Magnesium. 2 % unseres Körpers bestehen aus Calcium. Hydroxylapatit, , ist ein wichtiger Baustein unserer Knochen und Zähne.
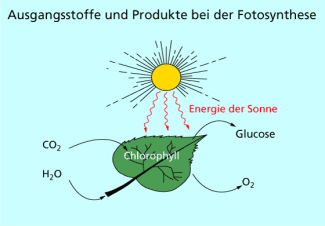
Magnesium ist das Zentralatom im Chlorophyll und somit an der umsatzstärksten Reaktion der Erde, der Fotosynthese von Kohlehydraten und Sauerstoff aus Wasser und Kohlenstoffdioxid beteiligt (Bild 5).
Ausgewählte Verbindungen der Erdalkalimetalle
Oxide und Hydroxide
Die Oxide entstehen bei der thermischen Zersetzung der Carbonate (Mg, Ca, Sr, Ba).
Magnesiumoxid MgO wird als Sintermagnesia zur Herstellung von Laborgeräten (Tiegel, Magnesiastäbchen) und als hochfeuerfester Baustoff genutzt.
-
Bei der Fotosynthese spielt das Magnesium enthaltende Chlorophyll die entscheidende Rolle.
Calciumoxid CaO (gebrannter Kalk, Branntkalk, Ätzkalk) wird mit Wasser zu Calciumhydroxid (Löschkalk) umgesetzt und als Bestandteil des Kalkmörtels verwendet. Beim Abbinden bildet sich mit Kohlenstoffdioxid aus der Luft Calciumcarbonat, dessen Kristalle die Baustoffe miteinander verbinden.
| Kalkbrennen: | |
| Löschen von Kalk: | |
| Abbinden von Kalkmörtel: | |
Halogenide
Alle 24 möglichen Halogenide der Erdalkalimetalle sind bekannt. Von den Fluoriden löst sich nur das Berylliumfluorid in Wasser.
Die Chloride, Bromide und Iodide sind teilweise sehr gut wasserlöslich.
Die löslichen Beryllium- und Bariumverbindungen sind stark giftig.
Andere Verbindungen der Erdalkalimetalle
Bei den Carbonate n ist besonders Calciumcarbonat von Bedeutung. Wichtige Mineralien wie Kalk, Kreide und Marmor, aber auch Perlen bestehen aus Calciumcarbonat, das auf unterschiedliche Weise kristallisiert. Mit Säuren werden die Carbonate aufgelöst, weil sich Kohlensäure bildet, die in Kohlenstoffdioxid und Wasser zerfällt. Saure Reinigungsmittel lösen daher Marmorplatten und Perlen auf.
Magnesium- und Calciumcarbonat verursachen die temporäre Wasserhärte, bilden aber auch die Tropfsteinhöhlen. In Wasser enthaltenes unlösliches Calcium- bzw. Magnesiumcarbonat reagiert mit Kohlenstoffdioxid aus der Luft und Wasser zu löslichem Calciumhydrogencarbonat. Beim Erwärmen von Wasser, das Hydrogencarbonat-Ionen enthält, läuft diese Reaktion in die entgegengesetzte Richtung und das schwer lösliche Carbonat fällt aus, es bildet sich Kesselstein.
Die Nitrate von Calcium, Strontium und Barium werden, wie auch Magnesiumpulver, in der Feuerwerkerei genutzt, weil sie bunte Flammenfärbungen zeigen. Calciumsalze ergeben eine orangerote, Strontium eine rote und Calcium eine grüne Färbung. Magnesium leuchtet sehr hell (Bild 9).
-
Unterschiedliche Flammenfärbung bei der Verbrennung von Magnesium und Barium

Heinz Mahler, Berlin
Das wichtigste Sulfat ist Calciumsulfat, das je nach eingelagertem Kristallwasser unterschiedliche Namen und Eigenschaften hat. Als Hemihydrat wird es „gebrannter Gips“ genannt und dient als Baustoff. Mit Wasser reagiert gebrannter Gips unter Volumenzunahme zum Dihydrat , das auch Gips genannt wird. Diese Volumenzunahme ermöglicht die Anfertigung von Gipsformen, die feinste Strukturen wiedergeben, denn sie bewirkt, dass Gips in die kleinsten Ausbuchtungen gedrückt wird.
Bariumsulfat ist ein schwer lösliches, chemisch beständiges Salz. Es wird als Weißpigment (Permanentweiß) z. B. in Malerfarben verwendet und dient als Füllstoff bei der Produktion von Papier und Gummi. Außerdem wird es als Kontrastmittel bei Röntgenuntersuchungen eingesetzt. Hierfür darf es keine Spuren von löslichen Bariumverbindungen enthalten, da diese giftig sind.
Suche nach passenden Schlagwörtern
- Beryll
- Oxide
- temporäre Wasserhärte
- Calciumcarbid
- Strontium
- Beryllium
- Metallothermie
- Calciumhydrid
- Berylliumoxid
- Magnesium
- Leichtmetalle
- Magnesiumoxid
- 2. Hauptgruppe
- Magnesiumhydrid
- Berylliumhydroxid
- Gips
- Calciumsulfat
- Carbonate
- Bariumsulfat
- Passivierung
- Berylliumhydrid
- Calciumoxid
- Calcium
- Calciumcarbonat
- Barium
- Radium
- Erdalkalimetalle
- Kalkstickstoff
- Bariumoxid

