Methan
Methan ist die organische Verbindung mit der einfachsten Struktur. Die Moleküle sind aus einem Kohlenstoffatom und vier Wasserstoffatomen aufgebaut. Methan ist das erste Glied der homologen Reihe der Alkane.
Das Gas ist Hauptbestandteil des Erdgases und wird hauptsächlich als Energieträger verwendet. Außerdem nutzt man es als Ausgangsstoff zur Herstellung von Ammoniak, Methanol und Halogenalkanen.
Methan ist immer für eine Überraschung gut, ob es als Sumpfgas für Legenden von Irrlichtern sorgte, als schlagende Wetter den Schrecken von Bergbauarbeitern bildet oder als Methanhydrat einerseits Euphorie, andererseits Befürchtungen um unser Klima auslöst.
Vorkommen
Methan ist Hauptbestandteil des Erdgases. Erdgas wird häufig im Zusammenhang mit Erdöl gefunden. Unter hohem Druck, hohen Temperaturen und Luftabschluss wurden die organischen Abfallstoffe über einen langen Zeitraum umgewandelt. Es bildeten sich sowohl gasförmige als auch flüssige Stoffe. Dabei sammelten sich Methan und die anderen kurzkettigen organischen Stoffe oberhalb des Erdöls, wenn ihr Entweichen durch entsprechende Gesteins- und Erdschichten verhindert wurde.
Methan entsteht generell bei der Zersetzung von organischem Material. So wurde Methan auch bei der Inkohlung organischen Pflanzenmaterials infolge der komplizierten chemischen Reaktionen abgespalten. Konnte es nicht entweichen, sammelte es sich in Hohlräumen, die sich in der Umgebung von Kohleflözen befinden (Grubengas). Hier sind die Methanvorkommen gefürchtet, denn Methangemische mit Sauerstoff sind explosiv. Entsprechende Unfälle passieren leider immer wieder (sogenannte „schlagende Wetter“).
Natürlich wird Methan auch heute bei vielen Zersetzungsprozessen freigesetzt, beispielsweise in Faultürmen von Abwasseranlagen, in Biogasanlagen oder am Grunde von tiefen Seen, wenn dort Sauerstoffmangel herrscht (Faulschlamm).
Unter den Bedingungen, die in einem Moor herrschen, bildet sich ebenfalls ein Gasgemisch, das Methan enthält – das Sumpfgas. Man schätzt, dass ca. 150 Mio. Tonnen pro Jahr in die Atmosphäre abgegeben werden. Manchmal entzündet sich das Sumpfgas. Man nimmt an, dass die Flammen die Ursache für die Geistergeschichten über Irrlicher in solchen Gegenden bilden könnten.
Überraschend groß ist die Menge an Gas, die durch die mikrobielle Umsetzung von Pflanzenmaterial im Verdauungssystem von Wiederkäuern (Rindern und Schafen) entsteht – 250 Mio. Tonnen pro Jahr. Auch von Reisfeldern, die in der Anfangszeit unter Wasser stehen, wird eine messbare Menge dieses Gases (schätzungsweise 250 Mio. Tonnen pro Jahr) abgegeben.
Seit einiger Zeit weiß man, dass es auch am Meeresgrund riesige Lagerstätten aus sogenanntem Methanhydrat existieren. Methanhydrat wird auch als brennbares Eis bezeichnet. Dieser Name bezieht sich darauf, dass die Substanz zwar aussieht wie Eis, aber aufgrund entweichenden Methans brennbar ist. Dadurch entsteht der Eindruck, Eis würde brennen.
Methanhydrat besteht aus Methan, welches in gefrorenem Wasser eingelagert ist. Die Wassermoleküle umschließen das Methan vollständig. Unter Normbedingungen (0 °C, 101,3 kPa) zerfällt Methanhydrat sehr schnell. Aufsehen erregete dieser Stoff, als 1999 vor der Küste Oregons von der Brücke eines deutschen Forschungsschiffs aus weiße Brocken auf der Meeresoberfläche beobachtet wurden, die stark schäumend immer kleiner wurden.
Methanhydrat bildet sich bei tiefen Temperaturen und hohem Druck-Bedingungen, die am Boden der Ozeane herrschen. Besonders an den Kontinentalrändern, wo der Meeresboden zur Tiefsee abfällt, lagern große Mengen dieses Stoffs. Es wird aber auch im Permafrostgebieten Sibiriens gefunden.
Struktur und Eigenschaften
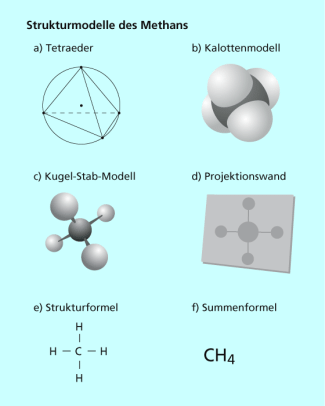
Methan ist die organische Verbindung mit der einfachsten Struktur. Die Moleküle sind aus einem Kohlenstoffatom und vier Wasserstoffatomen aufgebaut. Demnach gehört der Stoff zu den Kohlenwasserstoffen. Im Molekül sind die Wasserstoffatome mit dem Kohlenstoffatom jeweils über ein gemeinsames Elektronenpaar (eine unpolare Atombindung) verbunden und ist somit der Stoffklasse der Alkane zuzuordnen. Die vier gemeinsamen Elektronenpaare, die die Bindungen zwischen dem Kohlenstoffatom und den vier Wasserstoffatomen bewirken, stoßen sich ab. Daher sind die Atome nicht in einer Ebene gelagert, sondern räumlich ausgerichtet. Das Methanmolekül hat die Form eines Tetraeders (Bild 3). Zur Verdeutlichung kann man sich eine Kugel vorstellen, Die auf dem Mantel liegenden Punkte, die voneinander am weitesten entfernt sind, stellen die Ecken des Tetraeders da. Verbindet gedanklich den Kugelmittelpunkt mit den Tetraederecken, erhält man Modell, welches Bindungen mit ihren Winkeln im Methanmolekül wiederspiegelt. Besonders gut wird dies im Kugelstabmodell verdeutlicht.
Aus der Struktur der Methanmoleküle ergeben sich die Eigenschaften des Stoffes. Die Moleküle von Methan sind sehr klein, ihre Molekülmasse ist somit gering. Außerdem sind die Atombindungen zwischen dem Kohlenstoff- und den Wasserstoffatomen nur schwach polar. Daraus ergeben sich nur schwache Anziehungskräfte, die zwischen den Molekülen wirken. Methan ist bei Normbedingungen gasförmig und weist nur eine geringe Dichte auf.
- Schmelztemperatur: -182,5 °C
- Siedetemperatur: -161 °C
- Dichte (bei 25 °C und 101,3 kPa): 0,72 g/l
Da das Methanmolekül ein unpolares Molekül ist, löst sich Methan kaum in Wasser (polares Lösungsmittel), ist aber sehr gut in organischen (unpolaren) Lösungsmitteln wie Benzin löslich.
Methan ist das erste Glied der homologen Reihe der Alkane. Wie alle Kohlenwasserstoffe ist Methan brennbar. Es verbrennt mit blauer Flamme. Die vollständige Umsetzung mit Sauerstoff ist stark exotherm. Die Reaktion erfolgt explosionsartig, wenn sie unkontrolliert verläuft:
In Gasheizungen und Erdgasfahrzeugen wird jedoch Methan kontrolliert mit Luft umgesetzt, sodass die frei werdende Energie zum Beheizen von Häusern bzw. zum Antrieb von Autos nutzbar wird.
Da die unpolaren C-H-Bindungen relativ stabil sind, geht Methan neben der Verbrennung mit Sauerstoff nur wenige Reaktionen ein. Dazu zählen die unvollständige Oxidation zu Methanol und Substitutionsreaktionen mit Halogenen, die auch industriell genutzt werden.
Herstellung
Methan wird in der Technik durch eine Reinigung von Erdgas gewonnen werden (der Methananteil beträgt entsprechend der Zusammensetzung des Gemisches bis zu 90 %). Außerdem fällt Methan auch in großen Mengen bei der Erdölverarbeitung u. a. bei Crackprozessen an.
Eine Möglichkeit der Herstellung über chemische Reaktion ist die sogenannte FISCHER-TROPSCH-Synthese, bei der Kohlenstoffmonooxid mit Wasserstoff umgesetzt wird.
Verwendung und Bedeutung von Methan
Da Methan als relativ preiswerter Rohstoff in großen Mengen zur Verfügung steht, wird es als Ausgangsstoff für mehrere organische Synthesen genutzt. So werden durch Substitutionsreaktionen Halogenalkane z. B. Chloralkane (jedoch keine Iodalkane) gebildet.
Methan ist auch als Ausgangsstoff für die Ammoniaksynthese von Bedeutung. In einem mehrstufigen Prozess wird zuerst Methan mit Wasserdampf im Unterschuss katalytisch umgesetzt.
CH4 + H2O → CO + 3 H2
Das restliche Methan wird im zweiten Schritt mit Luft umgesetzt und auf diese Weise der erforderliche Stickstoff eingebracht.
2 CH4 + O2 + (4 N2) → 2 CO + 4 H2 + (4 N2)
Das in beiden Stufen gebildete Kohlenstoffmonooxid wird nun katalytisch mit Wasserdampf zu Wasserstoff und Kohlenstoffdioxid umgesetzt (Konvertierung).
Nach dem Auswaschen von Kohlenstoffdioxid reagieren Stickstoff und Wasserstoff im Kontaktofen zu Ammoniak. Die vorliegenden Prozessstufen sind derart aufeinander abgestimmt, dass Stickstoff und Wasserstoff im erforderlichen Verhältnis von 1 : 3 im Prozess entstehen.
Eine andere Möglichkeit besteht darin, ein Gemisch aus Kohlenstoffmonooxid und Wasserstoff zu Methanol umzusetzen:
Methan wird jedoch hauptsächlich wegen seiner stark exothermen Verbrennung (siehe oben) als Energieträger genutzt. So wird u. a. Erdgas (Hauptbestandteil Methan) direkt als Heizgas eingesetzt. Es dient auch als Energieträger für die Stromerzeugung bzw. wird für spezielle Kraftfahrzeuge als Brennstoff verwendet.
Gaskraftwerke zur Stromerzeugung können im Unterschied zu Kohlekraftwerken in ganz kurzer Zeit von Stillstand auf Volllast gefahren werden. Damit haben sie eine wichtige Funktion zur Deckung des Elektroenergiebedarfs in Spitzenzeiten.
Das in Faultürmen der Kläranlagen gebildete Biogas oder das in entsprechenden Anlagen aus organischen Abfällen produzierte Biogas kann ebenfalls als Heizgas Verwendung finden.
Methan – umweltschonender Energieträger oder nicht kalkulierbares Klimarisiko?
Methan ist als relativ umweltschonender Energieträger im Gespräch, weil bei seiner Verbrennung weniger Kohlenstoffdioxid pro erzeugter kWh freigesetzt wird als bei anderen fossilen Brennstoffen. Da Kohlenstoffdioxid ein Treibhausgas ist, würde z. B. durch die Nutzung von Methan bzw. von Erdgas anstelle von Benzin oder Diesel als Treibstoff für Kraftfahrzeuge ein geringerer Kohlenstoffdioxidausstoß die Folge sein.
In dem Zusammenhang ist neuerdings von den großen Lagerstätten mit Methanhydrat am Meeresboden die Rede. Dort lagern schätzungsweise zwölf Trillionen Tonnen. Das würde bedeuten, dass die gebundene Kohlenstoffmenge in ihm mindestens doppelt so hoch ist, wie die Menge an Kohlenstoff in Erdöl-, Erdgas- und Kohlevorkommen zusammen. In Anbetracht der sinkenden Vorräte der genannten fossilen Enrgieträger könnte Methanhydrat eine Energiequelle der Zukunft sein.
Allerdings gibt es beim Abbau Probleme. Bei steigender Temperatur und sinkendem Druck entweicht Methan, denn Methanhydrat ist unter Normbedingungen nicht stabil. Der Zerfall erfolgt schon, während das Methanhydrat zur Meeresoberfläche transportiert wird. So wird über Möglichkeiten nachgedacht, das Methaneis schon am Boden zu schmelzen und das freigesetzte Methan aufzufangen. Abgesehen von den technischen Problemen sind die Folgen des Abbaus und der Nutzung des Methanhydrats noch nicht abzuschätzen.
Methan ist nämlich auch ein Treibhausgas, das wesentlichen Einfluss auf das Klima hat. Der Effekt ist mehr als 20mal so stark wie der von Kohlenstoffdioxid. Wird beim Abbau des Methanhydrats ungenutztes Methan freigesetzt und gelangt es in die Atmosphäre, kann dies weit reichende Folgen haben.
Durch den Treibhauseffekt – der hauptsächlich durch das in viel größeren Mengen freigesetzte verursacht wird – kann jedoch eine gefährliche Spirale in Gang gesetzt werden. Einige Klimaforscher gehen davon aus, dass es durch die globale Erwärmung zu einer Fließänderung des Golfstromes kommt und sich so gerade die Gebiete am Meeresboden erwärmen könnten, in denen sich die Lagerstätten des Methanhydrats befinden. So könnte es zur Instabilität und Freisetzung großer Mengen Methans kommen, die den Treibhauseffekt in kaum abschätzbaren Ausmaß verstärken.
Die Folgen für das Klima und die Umwelt wären verheerend. Zum einen würde das Meerwasser noch weiter erwärmt und es könnte theoretisch alles Methan freigesetzt werden, das auf dem Meeresboden lagert. Dadurch werden unterseeische Beben und abrutschende Gesteinsmassen an den Kontinentalrändern ausgelöst, die riesige Tsunamis zur Folge haben und weite Landstriche für immer überfluten können. Zusammen mit dem durch den methanverstärkten Treibhauseffekt verursachten Abschmelzen der Polkappen würde sich das Antlitz der Erde grundlegend verändern.
Neuerdings nimmt man übrigens an, dass kleinere Gasaustritte von Methan die Ursache für das Verschwinden von Schiffen und Flugzeugen im geheimnisvollen Bermudadreieck sein könnten. Die Dichteveränderung des Wassers oder der Luft könnte zum Sinken bzw. zum Absturz geführt haben.
-
Modelle und Formeln des Methans