Proteine – Aufbau und Eigenschaften
Aminosäuren sind die Bausteine der Eiweiße. Aus nur 20 von ihnen werden alle Eiweiße gebildet, aus denen die Zellen aller Lebewesen, auch des Menschen, bestehen. Die Vielfalt der Eiweiße ist Grundlage für die unterschiedlichen Funktionen, die sie haben.
Bedeutung von Eiweißen im Körper
Eiweiße (Proteine) sind makromolekulare Naturstoffe, die an allen wesentlichen Lebensprozessen wie Stoff- und Energiewechsel, Vererbung und Fortpflanzung beteiligt sind. Sie erfüllen im menschlichen Körper sehr viele unterschiedliche Funktionen. So sind sie wesentlicher Aufbaustoff aller lebenden Zellen.
Die Eiweiße Myosin und Actin ermöglichen z. B. die Muskelkontraktion. Hämoglobin hat die Fähigkeit Sauerstoff zu binden und so zu transportieren.
Die Eiweiße des Blutplasmas bilden das Abwehrsystem unseres Körpers. Enzyme katalysieren Vorgänge in den Zellen.
Auch die Zellen von Tieren und Pflanzen bestehen aus Eiweißen.
Eiweiße sind die Grunsubstanz des Lebens.
Nach der Funktion im Körper/ in den Zellen können Eiweiße in verschiedene Gruppen eingeteilt werden.
![]()
Eiweiße muss man mit der Nahrung zu sich nehmen. Die meisten Pflanzen können diese lebenswichtigen Stoffe selbst herstellen. Mensch und Tiere müssen für ihren Körper Eiweiße aufnehmen.
![]()
Umwandlung von Eiweißen im Körper
Damit körpereigene Eiweiße aufgebaut werden können, müssen mit der Nahrung Eiweiße aufgenommen werden.
Mithilfe von Enzymen werden die Eiweiße aus der Nahrung in unserem Verdauungssystem in ihre wasserlöslichen Bestandteile zerlegt, die Aminosäuren.
In dieser Form können sie aufgenommen und transportiert werden. Aus den Aminosäuren bilden die Zellen durch neue Verknüfung in der Eiweißsynthese an den Ribosomen die für sie typischen eigenen Eiweiße.
Man schätzt, dass ein höher entwickelter Organismus 10 000 bis 1 000 000 000 verschiedene Eiweiße enthält.
-
Die Polypeptidketten, aus denen Eiweiße bestehen, werden in unserem Verdauungssystem abgebaut
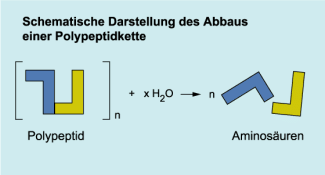
Synthese und Bau der Eiweiße
Zellen synthetisieren Eiweiße an den Ribosomen. Dazu werden die m- RNS, welche die Information von der DNS aus dem Zellkern holt und die t- RNS, welche die Aminosäuren bringt, benötigt.
Eiweiße besitzen die Peptidbindung.
Über diese besondere Bindung sind zwei Aminosäurereste miteinander verknüpft.
Aminosäuren haben sowohl die Carboxylgruppe als auch die Aminogruppe im Molekül.
Bei der Reaktion zweier Aminosäuren verknüpfen sich diese funktionellen Gruppen unter Wasserabspaltung.
Die Peptidbindung entsteht.
Reagieren viele Aminosäuren miteinander, entstehen Polypeptide (kettenförmige makromolekulare Verbindungen).
Da sich die 20 essenziellen Aminosäuren in unterschiedlicher Anzahl und Kombination miteinander verbinden können, ergibt sich eine große Vielfalt. Schon allein bei der Annahme, dass sich zwei Moleküle Glycin und zwei Moleküle Cystein miteinander verknüpfen, existieren vier Kombinationsmöglichkeiten:
| Glycin | – | Glycin | – | Cystein | – | Cystein |
| Glycin | – | Cystein | – | Cystein | – | Glycin |
| Cystein | – | Glycin | – | Glycin | – | Cystein |
| Glycin | – | Cystein | – | Glycin | – | Cystein |
Geht man davon aus, dass sich in einer Polypeptidkette durchschnittlich 100 Aminosäuremolekülreste befinden, so gibt es theoretisch verschiedene Polypeptidketten.
Struktur der Eiweiße
Die Polypeptidketten unterscheiden sich in der Art, Anzahl und Reihenfolge ihrer Aminosäuren (Aminosäuresequenz).
Die Aminosäuresequenz wird durch die Primärstruktur der Proteine wiedergegeben.
An verschiedenen Stellen des Eiweißmoleküls bilden sich Wasserstoffbrückenbindungen zwischen den CO- und NH-Gruppen der Peptidbindungen.
Dadurch entsteht die Sekundärstruktur.
Es existieren zwei Formen einer Sekundärstruktur.
- Bei der Helixstruktur sind die Aminosäurereste spiralig angeordnet.
- Eine Faltblattstruktur bildet sich durch die Zusammenlagerung gestreckter Peptidketten. Die Gesamtstruktur ähnelt einem zieharmonikaähnlich gefaltetem Blatt Papier.
Die Sekundärstruktur insgesamt kann eine räumliche Form haben.
Diese wird Tertiärstruktur genannt und beschreibt den vollständigen räumlichen Aufbau des Moleküls.
Manchmal sind noch mehrere Tertiärstrukturen zu einem Ganzen verbunden und bilden dann die Quartärstruktur (z. B. besteht das Hämoglobin aus vier Untereinheiten.)
Eigenschaften der Eiweiße
Durch Erhitzen, Bestrahlen, Zugabe von Säuren, Schwermetall-Ionen oder organischen Lösungsmitteln zu Eiweißlösungen werden die Strukturen meist irreversibel verändert.
Diesen Vorgang bezeichnet man als Denaturierung.
Bei der Denaturierung werden Strukturen der Eiweiße zerstört, z. B. die räumliche Anordnung der Polypeptidketten zueinander und innerhalb einer Polypeptidkette.
Dieser Vorgang kann beim Eierkochen beobachtet werden. Das Eiweiß gerinnt, es denaturiert.
Es gibt irreversible Denaturierung, die nicht umkehrbar ist, so wie beim gekochten Ei.
Manche Formen der Denaturierung sind jedoch auch umkehrbar.
Beim Dauerwellen von Haaren spielen ähnliche Prozesse eine Rolle, allerdings sind diese umkehrbar. Sie beruhen darauf, dass die Eiweißmoleküle lockiger Haare schwefelhaltige Seitenketten besitzen, die eine Vernetzung zwischen den Polypeptidketten hervorrufen. Dadurch rollen sich die Haare spiralig auf.
Durch chemische Mittel können solche Disulfid- Brücken künstlich erzeugt werden, das glatte Haar lockt sich.
Nachweis von Eiweißen
Bestimmte Eigenschaften der Eiweiße nutzt man für ihren Nachweis aus.
Eine Möglichkeit besteht in der Biuretreaktion . Hier überprüft man, ob Peptidbindungen vorliegen.
Die Biuretreaktion wird durch Zugabe von konzentrierter Kaliumhydroxidlösung (Vorsicht!) und einigen Tropfen hellblauer Kupfersulfatlösung zu der Testlösung durchgeführt.
Sind Peptidbindungen (Eiweiße) vorhanden, färbt sich die Lösung rotviolett.
-
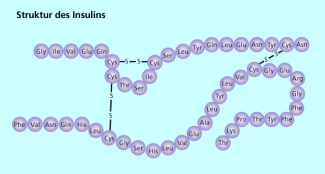
Das Hormon Insulin wird aus 17 verschiedenen Aminosäuren gebildet und enthält 51 Aminosäurereste, die in zwei Ketten angeordnet sind (Primärstruktur).
Bei der Xanthoproteinreaktion (griech.: xanthos = gelb) wird der zu testende Stoff mit konzentrierter Salpetersäure versetzt (Vorsicht!).
Sind Eiweiße in dem zu untersuchenden Stoff enthalten, ergibt sich eine charakteristische Gelbfärbung.
Mithilfe dieser Nachweise kann man feststellen, ob die Lebensmittel Eiweiße enthalten. Die Zusammensetzung kann man so nicht ermitteln.
Eiweiße in Nahrungsmitteln
Unsere Nahrung enthält Eiweiße in unterschiedlichen Anteilen.
![]()
Außerdem ist Eiweiß nicht gleich Eiweiß, denn die Zusammensetzung ist je nach Herkunft sehr unterschiedlich.
Für eine optimale Ernährung müssen in unserer Nahrung alle essenziellen Aminosäuren enthalten sein, damit auch alle Bausteine zum Aufbau aller körpereigenen Eiweiße vorhanden sind.
Nicht jedes Eiweiß hat die richtige Zusammensetzung.
Die Zusammensetzung der Eiweiße im Hühnerei entspricht etwa dem nötigen Verhältnis an Aminosäuren.
Neben Fetten, Mineralstoffen und Vitaminen hat ein durchschnittliches Hühnerei ungefähr einen Gehalt von 7 g Proteinen.
Dabei ist der Proteingehalt (Eiweißgehalt) im Eidotter (Eigelb) höher als im Eiklar (Eiweiß). Das Hühnerei hat für den Menschen eine hohe biologische Wertigkeit.
Die biologische Wertigkeit gibt an, wie viel Gramm körpereigenes Eiweiß aus 100 g des Nahrungseiweißes gebildet werden können. Weil die Eiweiße im Eiklar und Eidotter alle für den Menschen essenziellen Aminosäuren im günstigen Verhältnis enthalten, ist die biologische Wertigkeit dieser Eiweiße höher als beispielweise die der Eiweiße aus Fleisch und auch höher als die der pflanzlichen Eiweiße.

