Nachweisreaktionen organischer Naturstoffe
Die Nachweisreaktionen der Kohlenhydrate, Fette und Eiweiße sind mehr oder weniger spezifische Nachweisreaktionen der Stoffklassen. Anders als bei anorganischen Fällungs- oder Farbreaktionen sind die Reaktionsgleichungen oft sehr kompliziert und daher nur schwer darzustellen.
Die Vielfalt der makromolekularen Naturstoffe ist viel zu groß, als das man für jeden einzelnen Stoff einen spezifischen Nachweis entwickeln könnte. Deshalb nutzt man zur eindeutigen Identifizierung der Einzelstoffe heutzutage moderne instrumentelle Methoden wie die Massenspektroskopie oder elektrophoretische Verfahren. Stehen diese nicht zur Verfügung, muss man physikalische Eigenschaften wie Schmelzpunkte oder optische Drehwerte für eine eindeutige Identifizierung heranziehen.
Nachweisreaktionen organischer Verbindungen sind oft wenig spezifisch, d. h. die durchgeführte Farbreaktion (Bild 1) oder Fällung weist nicht auf einen speziellen Stoff, sondern nur auf eine ganze Stoffklasse hin. Die Ursache liegt u. a. darin, dass die Vielfalt der ca. 10 Mio. heute bekannten organischer Verbindungen viel größer ist, als die der anorganischen Stoffe (ca. 500 000). Deshalb identifiziert man organische Stoffe in der klassischen chemischen Analytik meist, indem man die einzelnen funktionellen Gruppen nachweist und dann die Zusammensetzung der Moleküle mittels quantitativer organischer Elementaranalyse bestimmt. Bestehen dann noch Zweifel an der Struktur, dann untersucht man physikalische Eigenschaften wie Schmelzpunkte, Siedepunkte oder Brechungsindizes und vergleicht diese mit tabellierten Werten der in Frage kommenden Verbindungen. In der modernen Analytik, also in gut ausgestatteten Forschungsinstituten geht man einen anderen Weg: Dort sind spektroskopische und andere instrumentelle Methoden verfügbar, mit denen man auch organische Stoffe schnell und eindeutig identifizieren kann.
Auch makromolekulare Naturstoffe sind am einfachsten mit teuren, computergestützten Analysemethoden nachweisbar. So nutzt man beispielsweise zur spezifischen Identifizierung von Eiweißen oder Nucleinsäuren moderne elektrophoretische Verfahren. In früheren Zeiten oder in einfach ausgestatteten Laboratorien bzw. Schulen sind solche Methoden jedoch kaum verfügbar und man greift deshalb immer noch auf die klassischen Nachweisreaktionen der Naturstoffe zurück. Diese sind für manche Stoffklassen ebenso unspezifisch wie für andere organische Verbindungen. Dagegen funktionieren andere Nachweise nur mit den gesuchten Verbindungen wie Stärke (siehe unten).
Deshalb ist es auch bei organischen Verbindungen wichtig, dass man zuerst das Aussehen und den Geruch der Stoffprobe betrachtet und daraus schon erste Schlussfolgerungen für das weitere Vorgehen zieht. Eine farblose, sehr viskose Flüssigkeit kann z. B. kein Kohlenhydrat sein, maximal eine wässrige Zuckerlösung. Umgekehrt ist ein weißer, kristalliner Feststoff kein Fett, da Fette Stoffgemische von öliger oder wachsartiger Konsistenz sind. Auch die Durchführung von Vorproben erspart eine Menge unnützer Arbeit. Ist man sich bei Feststoffen nicht sicher, ob es sich um einen Zucker oder ein Fett handelt, dann gibt man eine kleine Stoffprobe in Wasser. Löst sich die Substanz auf, dann handelt es sich wahrscheinlich um ein Mono- oder Disaccharid, löst es sich nicht, dann liegt ein Fett oder ein Polysaccharid vor.
-
Glucose-Nachweis durch Farbreaktion

Heinz Mahler, Berlin
Identifizierung von Kohlenhydraten
Zur Identifizierung von Kohlenhydraten gibt es mehrere Möglichkeiten. Am einfachsten ist die Umsetzung mit konzentrierter Schwefelsäure (gegebenenfalls unter vorsichtigem Erwärmen). Dabei wird dem Kohlenhydrat das Wasser entzogen und aus dem weißen Feststoff entsteht schwarzer Kohlenstoff (Bild 2). Wenn man mit dem Bunsenbrenner zu stark erwärmt, verkohlen jedoch auch andere Naturstoffe, sodass weitere Testreaktionen unumgänglich sind.
-
Verkohlung von Zucker mit konzentrierter Schwefelsäure
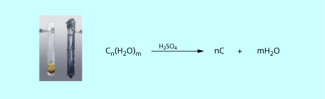
Heinz Mahler - H. Mahler, Fotograf, Berlin
Eine der beliebtesten ist die fehlingsche Probe, die darauf hinweist, dass der analysierte Stoff ein Zucker wie Glucose ist, der aufgrund seiner Aldehyd-Gruppe reduzierend wirkt. Nach Zugabe von fehlingscher Lösung I und II und Erwärmen beobachtet man einen ziegelroten Niederschlag von Kupfer(I)-oxid. Dieser Nachweis ist jedoch kein spezifischer Glucose-Nachweis. Auch Fructose, Maltose, Lactose sowie gewöhnliche Aldehyde gehen die gleiche Reaktion ein. Um die Zucker ohne strukturanalytische Methoden zweifelsfrei zu identifizieren, müssen daher die physikalischen Eigenschaften (Schmelzpunkt, optischer Drehwert etc.) untersucht werden.
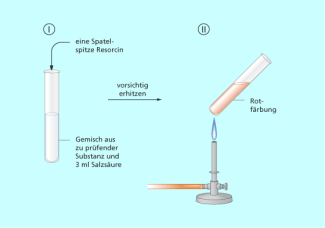
Auch andere Nachweisreaktionen für Kohlenhydrate sind wenig spezifisch. Bei der Umsetzung mit ammoniakalischer Silbernitratlösung oder wird ebenfalls nur die reduzierende Wirkung der Aldehyd-Gruppe nachgewiesen, indem Silber-Ionen zu schwarzem metallischen Silber reduziert. Fructose und andere Hexosen (Ketosen) sind mit der SELIWANOFF-Reaktion nachweisbar. Dazu versetzt man die Substanz mit verdünnter Salzsäure und Resorcin. und erwärmt vorsichtig. Ketosen wie Fructose reagieren in einer mehrschrittigen Reaktion mit Resorcin zu einem roten Farbstoff, der aber nicht als Niederschlag ausfällt (Bild 4). Aldosen geben diese Reaktion erst nach längerem Erwärmen.
-
SELIWANOFF-Probe zur Identifizierung von Ketosen wie Fructose
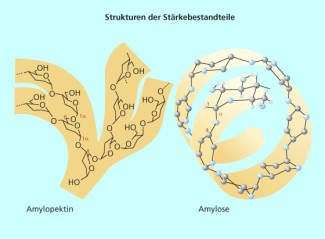
Ein spezifischer Nachweis ist dagegen der Stärkenachweis mit Iodkaliumiodid-Lösung. Stärke besteht zu ca. 25% aus dem Polysaccharid Amylose, das eine schraubenförmige Struktur besitzt (Bild 5). In die Hohlräume dieser Struktur werden Iodmoleküle eingelagert und das entstandene Produkt weist eine typische blauschwarze Färbung auf. Der Nachweis wird kaum durch andere Stoffe gestört. Die Farbe ist so intensiv, dass der Iod-Stärke-Komplex auch als Indikator für die iodometrische Titration genutzt wird.
-
Struktur der Stärkebestandteile Amylopektin und Amylose
Identifizierung von Eiweißen
Die Stoffklasse der Eiweiße kann durch mehrere Reaktionen sehr sicher nachgewiesen werden. Ein sehr einfacher Test ist die Denaturierung der Proteine beim Erwärmen oder durch Zugabe von Essig- oder Salzsäure (Bild 6). In beiden Fällen wird die Tertiär- und die Quartärstruktur irreversibel zerstört, das Eiweiß gerinnt. Noch sicherer sind die Xanthoprotein-Reaktion und die Biuret-Reaktion. Bei der Xanthoprotein-Reaktion setzt man der Analysensubstanz einige Tropfen konzentrierter Salpetersäure zu und beobachtet bei Eiweißen, die aromatische Aminosäurereste enthalten eine Gelbfärbung (griech.: xanthos = gelb). Die Gelbfärbung geht auf die Nitrierung des Aromaten in den Seitenketten der Aminosäuren zurück. Für die Biuret-Probe versetzt man die Probe mit 5 ml verdünnter Natronlauge und 5 Tropfen Kupfer(II)-sulfat-Lösung. In Gegenwart von Peptiden färbt sich die Lösung violett (Bild 7). Die charakteristische Färbung beruht auf der Bildung eines Kupfer(II)-Komplexes mit den freien Elektronenpaaren von 4 Stickstoffatomen der Peptidbindung als Liganden. Beide Nachweise sind insofern spezifisch als sie nur von der Stoffklasse der Proteine eingegangen werden. Aufgrund der ungeheuren Vielfalt der Eiweiße ist es unmöglich, einzelne Proteine mit einfachen chemischen Reaktionen eindeutig zu identifizieren. Dazu müssen leistungsfähige, instrumentelle Analysemethoden wie Massenspektroskopie, Röntgenstrukturanalyse und Elektrophorese herangezogen werden. Auch die Nucleinsäuren und ihre Nucleotidsequenz müssen mit solchen Methoden analysiert werden.
-
Denaturierung von Eiweißen durch Zugabe von Essigsäure

Heinz Mahler - H. Mahler, Fotograf, Berlin
-
Eiweiß-Nachweis durch die Biuret-Reaktion
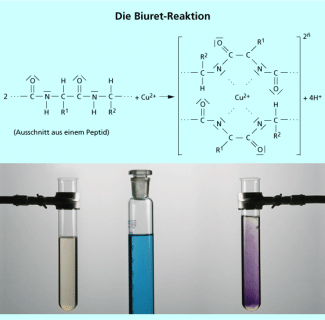
Heinz Mahler - H. Mahler, Fotograf, Berlin
Identifizierung von Fetten
Fette sind Stoffgemische aus verschiedenen Triestern des Glycerols. Ein spezifischer Nachweis bestimmter Fette ist nicht verfügbar. Fette erkennt man an ihrem typischen Löslichkeitsverhalten, sie lösen sich in unpolaren organischen Lösungsmitteln wie n-Hexan und in natürlichen Ölen. Allenfalls als Vorprobe dient die so genannte Fettfleckprobe: Dazu wird die Stoffprobe auf Filterpapier aufgetragen und im Trockenschrank (T < 100 °C) oder an der Luft getrocknet. Bleibt ein sichtbarer Fettfleck zurück, dann enthält die Substanz wahrscheinlich Fette. Einen weiteren Hinweis erhält man aus der Umsetzung mit dem organischen Farbstoff Sudan III. Dieser ist fettlöslich und zeigt die Gegenwart von Fetten durch eine deutliche Rotfärbung an.
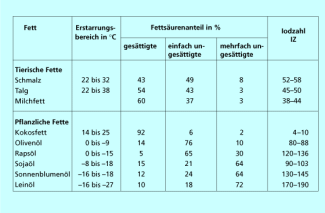
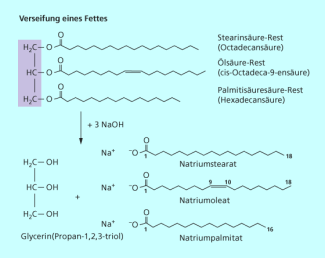
Durch Umsetzung mit starken Laugen wie Natronlauge kann man die Fette hydrolisieren und Seifen daraus herstellen (Verseifung, Bild 8). Allerdings unterliegen auch alle anderen organischen Ester der alkalischen Hydrolyse. Zur näheren Identifizierung der Fette nutzt man spektroskopische Methoden wie die NMR-Spektroskopie oder bestimmt die Iodzahl der Fette. Die Iodzahl gibt an, wie viel Gramm Iod in einer elektrophilen Additionsreaktion an 100 g Fett addiert werden können. Sie ist ein Maß für den Anteil ungesättigter Fettsäuren und erleichtert die Zuordnung der natürlichen Fette (Bild 9).
-
Verseifung von Fetten mit Natronlauge
-
Iodzahlen von natürlichen Fetten