Nachweis funktionelle Gruppen organischer Verbindungen
Das Reaktionsverhalten organischer Verbindungen wird maßgeblich durch die in den Molekülen enthaltenen funktionellen Gruppen bestimmt. Um die zu identifizierenden reinen Verbindungen einer Stoffklasse zuordnen zu können, führt man einfache Nachweisreaktionen durch, die ebenfalls auf Fällungs- oder Farbreaktionen beruhen.
Der Nachteil der meisten einfachen Nachweisreaktionen funktioneller Gruppen besteht darin, dass diese meist wenig stoffspezifisch sind, sondern nur Hinweise auf die entsprechenden Stoffklasse geben.
Analyse organischer Verbindungen
Das Reaktionsverhalten organischer Verbindungen wird maßgeblich durch die in den Molekülen enthaltenen funktionellen Gruppen bestimmt. Um die zu identifizierenden reinen Verbindungen einer Stoffklasse zuordnen zu können, führt man einfache Nachweisreaktionen durch, die ebenfalls auf Fällungsreaktionen oder Farbreaktionen beruhen.
Der Nachteil der meisten einfachen Nachweisreaktionen funktioneller Gruppen besteht darin, dass diese meist wenig stoffspezifisch sind, sondern nur Hinweise auf die entsprechende Stoffklasse geben.
In der modernen Chemie weist man funktionelle Gruppen schneller und zuverlässiger mittels spektroskopischer Methoden nach, die außerdem noch weitere Informationen zur Struktur der untersuchten Verbindung liefern.
Nachweis von Halogenverbindungen
Eine Möglichkeit besteht darin, die kovalent gebundenen Halogenatome in Halogenid-Ionen zu überführen und als Silbersalze auszufällen. Dazu erhitzt man die Analysensubstanz vorsichtig mit wenig in der Bunsenbrennerflamme. Nach dem Abkühlen wird der Rückstand in verdünnter Salpetersäure aufgenommen und mit einigen Tropfen -Lösung versetzt. Die Fällung schwer löslicher Silberhalogenide zeigt die Gegenwart der Halogenide an, die durch ihre Löslichkeit in Ammoniak voneinander unterschieden werden können.
Halogenverbindungen können auch mittels Flammenfärbung identifiziert werden. Dazu wird ein sauberer Kupferdraht in die Substanz getaucht und anschließend in die Bunsenbrennerflamme gehalten. Durch Bildung von Kupfer(II)-halogeniden färbt sich die Flamme grün.
Nachweis ungesättigter Verbindungen
Die Doppel- und Dreifachbindungen ungesättigter Kohlenwasserstoffe oder Fettsäuren können durch elektrophile Addition von Halogenen nachgewiesen werden. Für den qualitativen Nachweis setzt man einige Tropfen Bromwasser (3 % Brom in Wasser gelöst) zur Analysenlösung, die sich bei Anwesenheit ungesättigter Verbindungen entfärbt.
Alkene reagieren außerdem noch mit 2 %iger alkalischer -Lösung (BAEYER-Reagenz) zu Diolen. Permanganat wird dabei zu Braunstein reduziert, sodass sich die violette Lösung braun färbt. Diese Redoxreaktion wird von vielen anderen reduzierenden Substanzen, z. B. Aldehyden, gestört.
Aromatische Verbindungen geben diese Reaktionen nicht. Zur Prüfung, auf aromatische Strukturen, versetzt man die Probe mit trockenem Chloroform und frischem, wasserfreiem Aluminiumtrichlorid. Das Auftreten verschiedener Farbtönungen, z. B. tiefrot bei Benzen und Toluen, weist auf die Anwesenheit von Aromaten hin.
Nachweis von Aldehyden
Zum Nachweis der Aldehyd-Gruppe nutzt man in erster Linie ihre reduzierende Wirkung. Die klassische Reaktion ist die Fällung von ziegelrotem Kupfer(I)-oxid mit fehlingscher Lösung, die auch die Aldehyd-Gruppe der Zucker anzeigt. Bei der Zugabe ammoniakalischer Silbernitratlösung ( Tollens-Reagenz ) zu einem Aldehyd wird die Fällung von schwarzem, elementarem Silber oder die Abscheidung eines metallischen Silberspiegels beobachtet.
Beide Reaktionen werden auch von vielen Zuckern, z. B. den Aldosen, und anderen reduzierend wirkenden Substanzen eingegangen.
Mit fuchsinschwefliger Säure ( Schiffs-Reagenz ) wird schon in Gegenwart kleinster Mengen Aldehyde eine rotviolette Färbung beobachtet, der durch die Anlagerung der Aldehyde an das chromophore System des Fuchsins zurückgeht. Reduzierende Zucker gehen diese Reaktion nicht ein.
-
Flammenfärbung bei Halogenverbindungen

Heinz Mahler, Berlin
Nachweis von Alkoholen, Phenolen und Carbonsäuren
Der chemische Nachweis der Hydroxy-Gruppe und der Carboxy-Gruppe ist besonders schwierig, da es kaum einfache Farb- oder Fällungsreaktionen gibt, die charakteristisch für diese funktionellen Gruppen sind. Farbreaktionen geben vor allem Phenole mit 1 %iger durch die Bildung farbiger Eisen(III)-Komplexe.
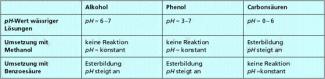
Hinweise auf Alkohole oder Säuren erhält man z. B. durch den Geruch der Proben (z. B. bei Essigsäure oder Ethanol) sowie ihre Löslichkeit in Wasser und den pH-Wert der wässrigen Lösungen. Alkohole reagieren neutral (pH=7), Phenole sind schwach sauer (pH = 3-7), während Carbonsäuren je nach Säurestärke und Konzentration pH-Werte von 0 bis 6 aufweisen können.
Als typische Reaktion kann eine Veresterung durchgeführt werden und die Änderung des pH-Werts während der Umsetzung z. B. mit Methanol oder mit Benzoesäure verfolgt werden. Da der gebildete Ester neutral ist, kann man aus der Änderung des pH-Werts gut erkennen, zu welcher der drei Stoffklassen die Analysensubstanz gehört. Außerdem sind Ester in der Regel schlecht wasserlöslich, d.h. man beobachtet die Abscheidung einer zweiten mit Wasser nicht mischbaren Phase, wenn eine Veresterung mit der Analysensubstanz erfolgt ist.
-
Nachweis von Alkoholen, Phenolen und Carbonsäuren
-
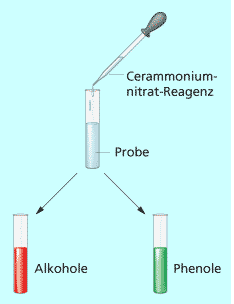
Der Nachweis von Alkoholen und Phenolen kann mithilfe des Cerammoniumnitrat-Reagenz geführt werden.
Suche nach passenden Schlagwörtern
- Veresterung
- Carboxy-Gruppe
- Farbreaktionen
- Hydroxy-Gruppe
- Aromaten
- Phenole
- Bromwasser
- Alkohole
- Tollens-Reagenz
- Schiffs-Reagenz
- Fällungsreaktionen
- Halogenverbindungen
- Nachweisreaktionen funktioneller Gruppen
- Analyse organischer Verbindungen
- Flammenfärbung
- Aldehyd-Gruppe
- funktionelle Gruppen
- Nachweis von Aldehyden
- spektroskopischer Methoden
- ungesättigter Kohlenwasserstoffe
- BAEYER-Reagenz

