Grundprinzip der Chromatografie
Bei der Chromatografie handelt es sich um ein physikalisches Trennverfahren, bei denen die Stofftrennung auf der unterschiedlichen Wechselwirkung der zu trennenden Substanzen zwischen einer stationären und einer mobilen Phase, die nicht miteinander mischbar sind, beruht. Chromatografische Analyseverfahren dienen zur qualitativen und quantitativen Analyse.
Bei der Chromatographie wird die Probe in einen Trägerstrom (Gas, flüssig), die sogenannte mobile Phase, eingeschleust und dann mit dieser zusammen an der Trennphase (der sogenannten stationären Phase) vorbeigeführt. Die Trennphase kann dabei als plane Schicht aufgebracht sein (PC, DC) oder sie befindet sich in einer Säule (Rohr), wie bei der GC, IC oder HPLC.
-
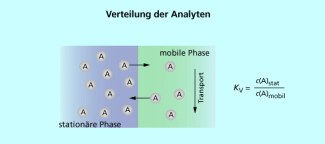
Verteilung des Analyten (A) zwischen mobiler und stationärer Phase
Die wichtigsten chromatografischen Analysenmethoden sind:
- Papierchromatografie
- Dünnschichtchromatografie (DC)
- klassische Säulenchromatografie (mit flüssiger mobiler Phase, LC)
- HPLC (Hochleistungsflüssigkeitschromatografie bzw. High Performance Liquid Chromatography)
- Ionenchromatografie (IC) als spezielle Form der HPLC
- Gaschromatografie (GC)
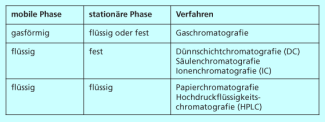
Die verschiedenen Arten der Chromatografie werden oft nach der Art der mobilen und stationären Phase eingeteilt (Bild 2).
Durch unterschiedlich starke Wechselwirkung der einzelnen Komponenten der Probe mit der stationären Phase haften sie unterschiedlich lange an der Trennphase und können deshalb unterschiedlich schnell mit der mobilen Phase mitgenommen werden. Auf diese Weise werden sie voneinander getrennt.
Das Chromatogramm als Ergebnis der Trennung kann sich in Form von Substanzflecken auf der stationären Phase befinden wie bei der Papier- und Dünnschichtchromatografie. Die andere Form des Chromatogramms erhält man bei den Varianten der Säulenchromatographie als ein Signal-Zeit-Diagramm. Dieses wird von einem Detektor geliefert, der die getrennten Stoffe beim Verlassen der Trennphase registriert.
Die Zeit, die ein Stoff benötigt, um die Trennstrecke zu durchlaufen, bezeichnet man als Retentionszeit (Rückhaltezeit). Die Retentionszeit eines Stoffs hängt von vielen Parametern ab. Durch Chromatografie von Testsubstanzen unter gleichen Bedingungen und Vergleich der Retentionszeiten miteinander lassen sich die Komponenten in der Probe identifizieren.
Die Trennwirkung kann auf unterschiedlichen Effekten (z. B. Adsorption, Verteilung oder ionische Wechselwirkung) beruhen. Unterschiedlich starke adsorptive Bindungen (Adsorptionschromatografie) werden insbesondere bei der Dünnschichtchromatografie ausgenutzt.
In der Gaschromatografie und der HPLC nutzt man meist die unterschiedliche Verteilung der Komponenten zwischen dem mobilen Trägergasstrom und der in Form eines dünnen Flüssigkeitsfilms vorliegenden stationären Trennphase aus (Verteilungschromatographie). Eine Maßzahl für die Stärke der Bindung der Analyten an die Trennphase ist dabei der Verteilungskoeffizient (Bild 1).
Der Verteilungskoeffizient bzw. der Verteilungssatz
wurde von W. NERNST (1864-1941) formuliert. Er gilt streng genommen nur für ideal verdünnte Lösungen.
Unterschiede in der Stärke von ionischen Wechselwirkungen werden bei der Ionenchromatografie genutzt. Oft treten diese Prozesse gleichzeitig auf, sodass eine scharfe Trennung schwierig ist.
Chromatografische Trennverfahren werden zur qualitativen und quantitativen Analyse in der Kriminalistik, Umwelt-, Arzneimittel- und Lebensmittelanalytik angewendet.
Zu den einzelnen Methoden findet man weiterführende Informationen in anderen Beiträgen.
-
Übersicht über die wichtigsten Methoden der Chromatografie