Spektroskopische Analysemethoden – UV-VIS-Spektroskopie und Fotometrie
Die UV-VIS-Spektroskopie ist eine elektronenspektroskopische Methode, bei der die Absorption von sichtbarem und UV-Licht hauptsächlich durch organische Moleküle gemessen wird. Sie wird in der Regel zur quantitativen Analyse eingesetzt.
UV-VIS-Spektroskopie
Ein kleiner Ausschnitt der elektromagnetische Strahlung ist das sichtbare Licht und der ultraviolette Bereich . Strahlung dieser Wellenlänge kann durch viele organische Moleküle absorbiert werden, u. a. durch alle farbigen Verbindungen. Im UV/VIS-Bereich werden nur die Bindungselektronen von Molekülen zu Übergängen angeregt, da sie am weitesten vom Atomkern entfernt sind. Dadurch wird Licht einer bestimmten Wellenlänge absorbiert und im Spektrum ein Absorptionsmaximum bzw. eine Absorptionsbande erhalten.
Bei der UV-VIS-Spektroskopie kann man zwei analytische Anwendungen unterscheiden. Bei der Spektroskopie wird das Spektrum, das heißt die Lichtabsorption in Abhängigkeit der Wellenlänge, registriert. Das Spektrum ist charakteristisch für die Verbindung. Die Stärke der Absorption hängt von der Konzentration ab. Bei der Fotometrie wird dieser Fakt zur quantitativen Bestimmung genutzt. Man misst bei einer konstanten Wellenlänge die Stärke der Lichtabsorption und ermittelt die Konzentration über eine Kalibrierfunktion.
Viele organische Verbindungen absorbieren im UV-Bereich und ihre Spektren sind wenig charakteristisch. Durch Doppelbindungen und Heteroatome im Molekül (Chromophore) wird die Absorption aber in den sichtbaren Bereich verschoben. Die organischen Farbstoffe mit mehreren Chromophoren im Molekül weisen daher mehr oder weniger ausgedehnte konjugierte Doppelbindungssysteme auf. Durch die Verschiebung der Absorption in den sichtbaren Bereich werden die Spektren auch zunehmend differenzierter und stoffspezifischer und können so zur Identifizierung des Stoffs mit herangezogen werden, was bei Verbindungen ohne Chromophore nicht möglich ist.
Bei der Aufnahme von Spektren ist auch zu beachten, dass das Lösungsmittel ebenfalls eine wellenlängenabhängige Absorption besitzt. Durch die Verwendung von Zweistrahl-Geräten, bei denen der Parallelstrahl durch eine Küvette mit dem reinen Lösungsmittel geleitet wird, erfolgt bei der Registrierung des Spektrums automatisch eine Korrektur.
Da die Spektren im UV-Bereich in der Regel nur wenige Banden aufweisen und eine Spektroskopie im sichtbaren Bereich nur bei farbigen Substanzen möglich ist, wird die UV-VIS-Spektroskopie nur selten für qualitative Nachweise genutzt. Die Fotometrie ist dagegen eine vielfach eingesetzte Methode zur quantitativen Bestimmung farbiger Verbindungen, sowohl organischer als auch anorganischer Ionen in Form ihrer Komplexverbindungen, beispielsweise kann man Kupfer in Form des blauen Tetrammin-Komplexes bestimmen.
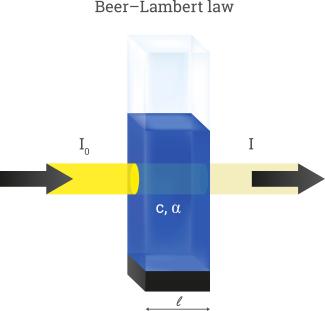
Durchdringt ein Lichtstrahl eine homogene Probelösung so verliert er infolge Absorption A an Intensität. Die Intensitätsabnahme ist nach dem LAMBERT-BEER-Gesetz proportional zur Konzentration der Lösung und der Schichtdicke der Probe, die das Licht durchdringen muss.
Das Absorptionsvermögen A wird auch als Extinktion E bezeichnet. Sie ist das logarithmische Verhältnis der Lichtintensität vor und nach der Küvette bei der gegebenen Wellenlänge des Lichts.
A = E = lg (I0/I)
Man misst in der Regel bei der Wellenlänge des Absorptionsmaximums, weil man dadurch die höchste Empfindlichkeit der Messung erzielt. Gerätetechnisch wird das dadurch erreicht, dass mithilfe des Monochromators das weiße Licht der Lampe spektral zerlegt wird und die gewünschte Wellenlänge durch den Spalt auf die Probe gelangt.
-
Aufbau eines UV-VIS-Spektrometers
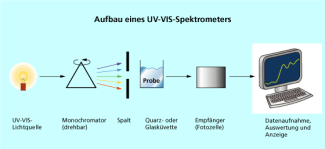
-
UV-VIS-Spektrum von β-Carotin
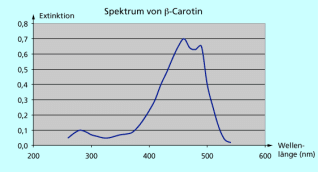
-
UV-VIS-Spektrum von Methylenblau
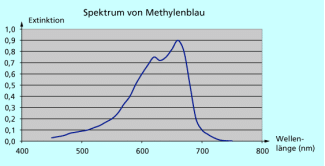
Das LAMBERT-BEER-GESETZ gilt bei Verwendung monochromatischem Lichts und für klare verdünnte Lösungen (E = 0,2 bis 0,8). Durch Aufnahme einer Kalibriergeraden ermittelt man grafisch die zu jeder Konzentration gehörende Extinktion. Der Anstieg der Geraden entspricht dem Extinktionskoeffizienten e und ist bei einer bestimmten Temperatur, Lösungsmittel und Wellenlänge des eingestrahlten Lichts eine stoffspezifische Konstante.
Die Fotometrie kann zur Analyse aller farbigen, löslichen Substanzen, z. B. Farbstoffe, anorganische und organische Komplexverbindungen eingesetzt werden. Aufgrund ihrer Einfachheit, Genauigkeit und Reproduzierbarkeit nutzt man sie vielfach in der Lebensmittel-, Arzneistoff- und Umweltanalytik z. B. zur quantitativen Bestimmung von Riboflavin (Vitamin B2) in Multivitamingetränken.
Mithilfe eines UV-Fotometers kann man auch farblose Molekülverbindungen, die Absorptionen im UV-Bereich zwischen 200 und 400 nm aufweisen, quantitativ bestimmen. So wird z. B. der Benzoesäuregehalt (Konservierungsstoff E 210) in einem Fischsalat mit dieser Methode analysiert.
Auch die bekannten Teststäbchen zur schnellen visuellen halbquantitativen Bestimmung von Konzentrationen gelöster Stoffe, beispielsweise der Wasserhärte, beruhen auf diesem Prinzip (Bild 5).
-
Mithilfe von Teststäbchen lassen sich Konzentrationen gelöster Stoffe schnell visuell halbquantitativ bestimmen.

Boris Mahler, Berlin
-
Durch Aufnahme einer Eichkurve ermittelt man grafisch die zu jeder Konzentration gehörende Absorption.
petrroudny - adobe stock

