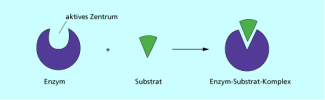
Schlüssel-Schloss-Prinzip
Enzyme sind Biokatalysatoren, die chemische Reaktionen innerhalb eines Organismus beschleunigen. Die meisten Enzyme sind proteiner Herkunft. Die Wirkung der meisten Enzyme ist in der Regel sehr spezifisch. Zum einen bezieht sich diese Spezifik auf den Reaktionstyp zum anderen auf die Substrate, deren Umsetzung sie katalysieren. Hochspezifische Enzyme katalysieren nur die Spaltung eines Bindungstyps (also eines Substrats), andere besitzen eine enge Kopplung an den Reaktionstyp (Wirkungsspezifität), akzeptieren aber eine Vielzahl verschiedener Substrate. Enzyme „erkennen“ ihre Substrate in sehr charakteristischer Weise. Die Ursache dafür liegt im aktiven Zentrum, das den Substraten eines Enzyms angepasst ist.
Bau und Wirkung der Enzyme basieren auf der Schlüssel-Schloss-Theorie
Damit eine Zelle am Leben erhalten wird, müssen z. B. im Stoffwechsel oder bei der Reizleitung Tausende von chemischen Reaktionen mit hoher Geschwindigkeit ablaufen. Deshalb besitzt jede Zelle biologische Katalysatoren, sogenannte Enzyme, die diese Reaktionen millionenfach, manchmal sogar milliardenfach beschleunigen.
Im Vergleich zu anderen Katalysatoren wirken Enzyme mit hoher Spezifität. Ein bestimmtes Enzym katalysiert nicht jede beliebige Reaktion sondern setzt nur ganz bestimmte Substrate um. Diese Eigenschaft nennt man Substratspezifität. Wie erkennt ein Enzym „sein“ Substrat? Enzyme besitzen ein aktives Zentrum, das aus räumlich benachbarten Aminosäureresten der Proteinstruktur gebildet wird und die katalytisch wirksame Region des Enzyms darstellt (Bild 1).
Die Erkennung des bestimmten Substrats geschieht nach dem Schlüssel-Schloss-Prinzip, welches von EMIL FISCHER 1894 entdeckt wurde. Das aktive Zentrum des Enzyms ist vorgeformt, so dass ein Substrat nur in einer ganz bestimmten Orientierung binden kann. Die Schlüssel-Schloss-Theorie geht vom Zusammenpassen von Molekülen aufgrund ihres komplementären Baus aus. Enzym und Substrat passen zusammen wie der Schlüssel zu einem Schloss. Die Substratbindung wird also ermöglicht, weil die Gestalt des aktiven Zentrums komplementär zu einer Stelle im Substrat passt.
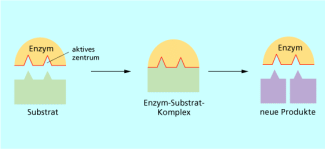
Dieser bildliche Ausdruck hat sich als sehr fruchtbar für die Enzymforschung erwiesen. Er erklärt auf einfache Weise die Substratspezifik der Enzyme. 1958 wurde das Modell von DANIEL E. KOSHLAND JR. weiterentwickelt. Er fand heraus, dass das aktive Zentrum vieler Enzyme erst nach der Bindung mit dem Substrat eine dazu komplementäre Form annimmt. Im dynamischen Prozess erkennt das Enzym das Substrat und passt die Gestalt des aktiven Zentrums an (Bild 2).
Die moderne Theorie beschreibt die Wirkungsweise nach dem Induced-Fit-Modell.
Außerdem katalysiert ein bestimmtes Enzym in Abhängigkeit von den Eigenschaften des aktiven Zentrums nicht jede beliebige Reaktion, sondern setzt das Substrat zu ganz bestimmten Produkten um. Diese Eigenschaft nennt man Wirkungsspezifität. Die aktiven Zentren werden oft von funktionellen Gruppen benachbarter Aminosäuren des Peptids gebildet. Diese sind häufig um Metallionen koordiniert (Mg, Zn, Fe), wodurch die spezifische Geometrie des Zentrums gebildet wird. Weiterhin können auch intermediär gebundene Coenzyme die Struktur des aktiven Zentrums beeinflussen. Coenzyme können komplexe organische Moleküle, z. B. Adenosintriphosphat, sein. Sie werden durch die Enzymreaktionen, an denen sie beteiligt sind, chemisch verändert. Oft dienen sie als Elektronendonator oder -akzeptor in Redoxreaktionen bzw. als Donator oder Akzeptor in Gruppentransferprozessen. Weil sich die Coenzyme direkt an der Reaktion beteiligen, nennt man sie auch Cosubstrate oder Cofaktoren.
-
Das Schlüssel-Schloss-Prinzip bedingt die Substratspezifität von Enzymen.
-
Das Enzym erkennt die Gestalt des Substrats und wird durch dieses aktiviert.