Schmelzflusselektrolyse
Aluminium ist eines der wichtigsten industriell hergestellten Metalle, das in erster Linie im Flugzeug- und Fahrzeugbau verwendet wird.
Die technische Herstellung von Aluminium erfolgt in zwei Stufen: Zuerst wird aus dem Rohstoff Bauxit reines Aluminiumoxid gewonnen, anschließend wird das Oxid in geschmolzenem Kryolith () gelöst und daraus mittels Schmelzflusselektrolyse Aluminium hergestellt.
Die Elektrolyse und die vorgelagerten Prozesse sind außerordentlich energieintensiv, sodass die Herstellung des Metalls durch Recycling von Aluminium zunehmend an Bedeutung gewinnt.
Aluminium ist nach Eisen das zweitwichtigste technische Metall und wird vielseitig verwendet. In Deutschland kommen etwa 40 % dieses Leichtmetalls im Fahrzeug- und Flugzeugbau zum Einsatz, etwa 20 % im Bauwesen, der Rest verteilt sich auf den Einsatz in Maschinenbau, Elektroindustrie und Verpackungsindustrie.
Geschichte der Aluminiumherstellung
Die Herstellung von Aluminium gelang - bedingt durch seine hohe Affinität zum Sauerstoff - erst im 19. Jahrhundert, indem sehr starke Reduktionsmittel wie die Alkalimetalle verwendet wurden. Leicht erhältliche Reduktionsmittel wie z. B. Kohlenstoff, die in anderen technischen Verfahren wie dem Hochofenprozess eingesetzt werden, reichen nicht aus, um das relativ unedle Aluminium herzustellen.
Erst Ende des 19. Jahrhunderts fand man mit der elektrolytischen Reduktion von Aluminiumoxid ein brauchbares Verfahren zur großtechnischen Herstellung, das noch heute angewendet wird.
Der Däne HANS CHRISTIAN OERSTED erhielt 1825 erstmalig unreines Aluminium durch Reduktion von Aluminiumchlorid mit Kaliumamalgam, einer Legierung aus Kalium und Quecksilber.
F. WÖHLER stellte 1827 das reine Metall durch Reduktion von mit Kaliummetall her. Er beschrieb es genau und wird daher meist als der Entdecker angesehen.
Der Franzose HENRI SAINT-CLAIRE DEVILLE setzte später metallisches Natrium ein und hatte damit das erste technisch brauchbare Verfahren entwickelt.
H. DEVILLE und ROBERT BUNSEN gelang 1854 unabhängig voneinander die Darstellung des Metalls durch Elektrolyse einer .
Zu dieser Zeit war das Metall so kostbar, dass es auf der Pariser Ausstellung 1855 neben den Kronjuwelen gezeigt wurde, und der Kaiser Napoleon III. benutzte bei Staatsempfängen Bestecke aus Aluminium als besondere Attraktion.
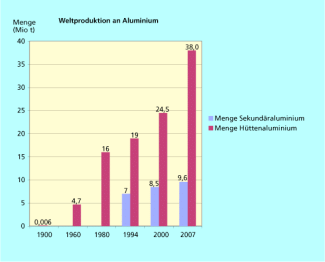
Die Bereitstellung billiger Elektroenergie mit der Entwicklung des Dynamos durch W. von SIEMENS nach 1870 und die Entwicklung der Elektrolyse von Aluminiumoxid in geschmolzenem Kryolith 1886, unabhängig voneinander durch PAUL L. T. HÉROULT in Frankreich und CHARLES M. HALL in den USA, die beide damals erst 22 Jahre alt waren, brachten den Durchbruch zur großtechnischen Produktion. 1893 überstieg die Weltproduktion erstmals 1000 Tonnen/Jahr und stieg dann außerordentlich rasch an (Bild 2).
-
Weltproduktion an Aluminium
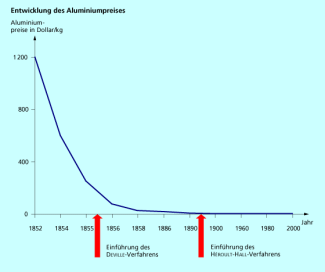
Die Verbesserung in den Herstellungsverfahren spiegelt sich auch in der Entwicklung des Aluminiumpreises wieder (Bild 3).
Herstellung von Aluminium durch Schmelzflusselektrolyse
1. Gewinnung von Aluminiumoxid (Bayer-Verfahren)
Als Rohstoff für die Aluminiumherstellung dient Bauxit, aus dem im ersten Schritt Aluminiumoxid gewonnen wird.
Bauxit ist ein rötlich gefärbtes Sedimentgestein, das im Tagebau gewonnen wird. Der für die Aluminiumgewinnung eingesetzte Rohstoff hat etwa folgende Zusammensetzung:
Aluminiumoxid () ca. 60 %
Eisenoxid () 7-30 %
Siliciumoxid () 1-15 %
Titanoxid () 3-5 %
chemisch gebundenes Wasser 12-30 %
Aluminium liegt im Bauxit in Form der Hydroxide vor, als oder AlO(OH). Eisen ist als Oxidhydrat, Silicium als Dioxid oder in Form von Silikaten enthalten.
Die Vorräte an Bauxit auf der Erde sind sehr groß, sie betragen 40-50 Milliarden Tonnen, die jährliche Welt-Förderung lag 1995 bei 100 Millionen Tonnen, im Jahr 2008 schon bei 205 Millionen Tonnen, Tendenz weiter steigend.
Die großen Bauxitvorkommen sind mit dafür verantwortlich, dass Aluminium nach Sauerstoff und Silicium mit einem Anteil von 8,3 Masse-% das dritthäufigste Element der Erdkruste ist. Viele silikatische Mineralien (Ton, Kaolin u. a.) enthalten ebenfalls Aluminium, allerdings sind diese Mineralien wegen des nicht so hohen Aluminiumgehalts kaum als Rohstoff geeignet. Für die Gewinnung von Aluminium wird fast nur Bauxit verwendet.
-
Entwicklung des Aluminiumpreises
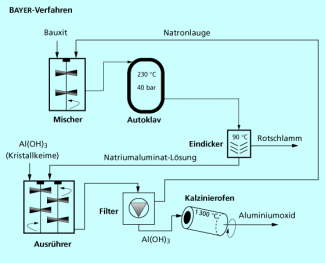
In der ersten Verarbeitungsstufe müssen die anderen Mineralien im sogenannten Bayer-Verfahren (Bild 4) vom Aluminiumhydroxid abgetrennt werden. In diesem Prozess wird der gemahlene Bauxit mit 25-45 %iger Natronlauge unter Druck bei 120 bis 230°C aufgeschlossen. Die Konzentration der Natronlauge, die Aufschlussdauer und die erforderliche Temperatur hängen von der Art des Bauxits ab.
Aluminiumhydroxid ist im Gegensatz zu den Begleitstoffen im Bauxit in Natronlauge unter Bildung von Aluminat-Ionen weitgehend löslich.
Die nicht gelösten Bestandteile des Bauxits - hauptsächlich Eisenoxid, Siliciumoxid und Titanoxid sowie etwas Aluminiumhydroxid - werden bei etwa 90 °C abfiltriert, gewaschen und bilden den sogenannten Rotschlamm, dessen Farbe von den Eisenoxiden herrührt. Dieser wird meist deponiert, kann aber auch als Rohstoff z. B. im Straßenbau genutzt werden.
Die Natriumaluminatlösung wird abgekühlt und dann mit festem Aluminiumhydroxid als Kristallisationskeim versetzt, um die Kristallisation des Produktes in Gang zu setzen. Diesen Vorgang bezeichnet man als Animpfen, die festen - Kristalle auch als Impfkristalle. Das gelöste Aluminat fällt nun als Aluminiumhydroxid wieder aus. Die zurückbleibende Natronlauge wird durch Eindampfen auf die Ausgangskonzentration gebracht und im Kreislauf zum Aufschluss zurückgeführt. Verluste werden durch Zusatz von frischer Lauge ergänzt.
Das Aluminiumhydroxid wird gewaschen und dann in Drehrohröfen auf 1200-1300°C erhitzt. Der Durchmesser dieser Öfen beträgt bis zu 3 m, ihre Länge bis zu 70 m. Unter Wasserabspaltung wird dabei das Hydroxid zum Oxid umgesetzt, ein Vorgang, der auch als Kalzinierung bezeichnet wird.
Das so gewonnene Aluminiumoxid hat eine Reinheit von über 99,5%, es enthält noch je ca. 0,01% Eisenoxid und Siliciumoxid sowie bis zu 0,4% Natrium.
-
Schema des Bayer-Verfahrens
2. Schmelzflusselektrolyse von Aluminiumoxid
Die Reduktion von Aluminiumoxid zum Metall erfolgt elektrolytisch in einer Schmelze. Da der Schmelzpunkt des reinen Oxids über 2000 °C liegt, löst man 5-10 % Aluminiumoxid in einer Schmelze von Kryolith. Bei einer solchen Mischung von Kryolith und Aluminiumoxid liegt der Schmelzpunkt niedriger als bei den beiden Einzelsubstanzen.
Kryolith (Natriumhexafluoroaluminat ) ist ein relativ seltenes natürliches weißes Mineral. Der Abbau der ehemaligen Hauptvorkommen in Grönland ist nicht mehr lohnend, daher wird die Verbindung aus Aluminiumhydroxid, Natronlauge und Fluorwasserstoffsäure hergestellt.
Der Kryolithschmelze werden außerdem verschiedene Salze zugemischt, deren Aufgabe es ist, den Schmelzpunkt zu senken, die Leitfähigkeit zu erhöhen und die Stromausbeute zu verbessern. Typische Zusammensetzung der Schmelze: 80-85 % ; 5-7 % ; 5-7 % ; LiF; darin sind 5-10% gelöst. Die Temperatur der Schmelze von 940 - 980 °C wird aus Elektroenergie erzeugt.
Die Elektrolysezelle ist eine feuerfest ausgemauerte Stahlblechwanne. Das Oxid liegt in der Schmelze in Form seiner Ionen als und vor. An der Katode, die aus Kohle besteht, werden Aluminiumionen zum Metall reduziert.
Das flüssige Aluminium sammelt sich unter der Schmelze und wird regelmäßig durch Anlegen eines Vakuums abgesaugt.
Auch die Anode besteht aus Kohle, hier werden die Oxid-Ionen zu Sauerstoff oxidiert, der mit dem Anodenmaterial zu Kohlenstoffmonooxid und Kohlenstoffdioxid reagiert.
Da die Kohleanode durch die Reaktion mit Sauerstoff verbraucht wird, muss sie von Zeit zu Zeit erneuert werden.
Durch die Abscheidung von Aluminium und Sauerstoff nimmt der Gehalt von Aluminiumoxid in der Schmelze ab, weswegen regelmäßig Oxid nachgegeben wird, um die gewünschte Konzentration zu halten.
Energiebedarf zur Aluminiumherstellung
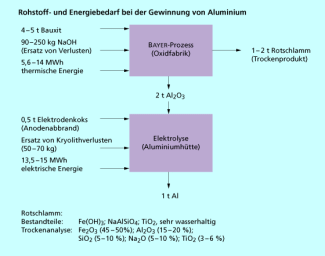
Der Energiebedarf für die Herstellung von Aluminium durch Schmelzfluss-Elektrolyse ist sehr hoch, allein für den Elektrolyseprozess benötigt man 13-15 MWh je Tonne Aluminium (Bild 6). Das entspricht etwa dem durchschnittlichen Jahresverbrauch an Elektroenergie von 5-10 Haushalten. In Deutschland werden 2-3% der Elektroenergie allein für die Aluminium-Schmelzflusselektrolyse eingesetzt. Aus diesem Grunde wird Aluminium weltweit in großem Umfang in solchen Ländern produziert, wo Elektroenergie billig durch Wasserkraft erzeugt werden kann (z. B. Norwegen, Südamerika).
Rechnet man noch den Energiebedarf zur Herstellung des Aluminiumoxids aus Bauxit in Form von Elektroenergie und thermischer Energie hinzu, so ergibt sich daraus ein Gesamtenergieverbrauch von etwa 40 MWh je Tonne Aluminium. Der Gesamtenergiebedarf zur Herstellung von 1 Tonne Glas beträgt dagegen nur etwa 3 MWh!
Prinzipiell kann man Aluminium sehr gut recyceln. Der Energiebedarf hierfür ist viel geringer, er beträgt nur 5-10 % des Bedarfs für Primärmaterial. Aufgrund der hohen Energiepreise ist das Recycling also durchaus attraktiv, so werden z. B. Aluminiumabfälle und Schrott aus dem Automobilbau zu 90 % wiederverwertet.
Die Recyclingquote von Aluminium aus Bauwesen, Elektrotechnik und Verpackung beträgt in Europa 80-90 %. In Deutschland liegt die Recyclingrate insgesamt für Aluminium bei knapp 70 %. Im Jahr 2008 wurde in der BRD infolge des viel geringeren Energiebedarfs sogar mehr Sekundäraluminium (ca. 700 000 t) als Primärmaterial (ca. 600 000 t) erzeugt.
-
Rohstoff- und Energiebedarf zur Aluminiumherstellung