Silicium und Siliciumverbindungen
Silicium als Element der IV. Hauptgruppe ist das zweithäufigste Element in der Erdkruste. Allerdings kommt es nur in Form von Siliciumdioxid und davon abgeleiteten Verbindungen, z. B. den Silicaten, vor. Viele Gesteine und Mineralien wie Quarz, Feldspat oder Tonerden sind Silciumverbindungen. Reines Silicium kann nur industriell hergestellt werden und ist von großer Bedeutung als Halbleiter in elektronischen Bauelementen und in der Solartechnik.
Siliciumdioxid und Silicate sind die Hauptbestandteile von Glas, finden aber auch andere vielfältige Anwendungen, z. B. als Schleifmittel oder technische Katalysatoren. Auch leistungsfähige keramische Werkstoffe und die als Dichtungsmaterial bekannten Silicone sind Verbindungen des Siliciums.
Das Siliciumatom besitzt 14 Protonen und meist 14 Neutronen im Atomkern sowie 14 Elektronen in der Atomhülle.
Die dritte Elektronenschale ist mit vier Elektronen unvollständig besetzt, sodass Silicium vier Außenelektronen und 10 Elektronen auf den inneren Schalen besitzt. Um eine stabile Achterschale zu erreichen, könnte ein Siliciumatom vier weitere Elektronen aufnehmen oder abgeben. Die so entstehenden vierfach geladenen Silicium-Ionen wären jedoch nicht sehr stabil. Aus diesem Grund geht Silicium fast immer 4 Atombindungen ein, um ein Elektronenoktett zu erreichen.
Als Element der 3. Periode kann Silicium in seltenen Fällen auch mehr als vier Atombindungen zu geeigneten Partnern ausbilden.
Struktur des Siliciums
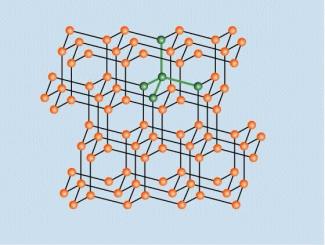
Siliciumatome bilden Atomgitter, in denen jedes Siliciumatom tetraedrisch mit vier weiteren Siliciumatomen verbunden ist. Auf diese Weise sind alle vier Außenelektronen an Atombindungen beteiligt und jedes Atom verfügt über ein Elektronenoktett. Es entsteht eine regelmäßige dreidimensionale Struktur, die dem Diamantgitter entspricht.
Vom Silicium existieren keine weiteren Modifikationen. Silicium ist jedoch trotzdem ein Halbleiter, da das Element bei hohen Temperaturen den elektrischen Strom leitet. Die Ursache besteht darin, dass mit zunehmender Temperatur Elektronen aus den Atombindungen beweglich werden und die Leitfähigkeit ansteigen lassen. Anders als Kohlenstoff ist Silicium ein Halbmetall.
Reaktionen des Siliciums
Reines Silicium ist reaktionsträge. Bei Zimmertemperatur reagiert es nur mit dem sehr reaktiven Fluor zu Siliciumtetrafluorid (). Die Umsetzung mit den übrigen Halogenen zu den entsprechenden Tetrahalogeniden läuft nur bei höheren Temperaturen ab.
An der Luft verbrennt Silicium erst bei Temperaturen oberhalb 1 000 °C zu Siliciumdioxid, . Bei der Verbrennung bildet sich eine sofort eine Schutzschicht aus Siliciumdioxid, die den weiteren Zutritt von Sauerstoff zum Metall erschwert.
In Säuren (ausgenommen in Fluss-Säure; HF) ist Silicium praktisch unlöslich, da auch hier die Oxidschutzschicht die Reaktion zwischen Säure und Metall erschwert.
Dagegen löst sich Silicium leicht in heißen Laugen unter Bildung von Wasserstoff und Silicaten.
-
Struktur des Siliciumgitters
Vorkommen und Bedeutung
Silicium kommt in der Natur nur in Form von Verbindungen vor, die sich fast ausschließlich vom Siliciumdioxid () bzw. der dazugehörigen Kieselsäure (H4SiO4) ableiten lassen. Es ist nach Sauerstoff das zweithäufigste Element der Erde, Sauerstoff ist mit 49 % und Silicium mit 26 % am Aufbau der Erdkruste beteiligt. Reines Silicium wird in großen Mengen als Halbleitermaterial für Mikrochips benötigt und ist dadurch ein wichtiges Produkt in der Mikroelektronik und der Solartechnik. Außerdem ist Silicium ein wichtiges Legierungsmetall.
Handelsformen des Siliciums
| Vom metallischen Silicium existieren drei Handelsformen: Ferrosilicium, technisches Silicium und Reinstsilicium. | |
| 1. | Ferrosilicium (FeSi) ist eine Legierung aus Eisen und Silicium mit einem Siliciumgehalt von 10-90 %. Man erhält sie durch Reduktion von Eisenoxid-haltigem Quarzsand mit Kohlenstoff. Weiterhin fällt diese Legierung bei der Aufarbeitung anderer Rohstoffe als Nebenprodukt an. Verwendet wird Ferrosilicium als Legierungsbestandteil für Eisen und korrosionsbeständige Gusslegierungen. |
| 2. | Technisches Silicium mit einem Reinheitsgrad zwischen 98,5-99 % wird in ähnlicher Weise hergestellt wie Ferrosilicium, aber aus möglichst reinem Siliciumdioxid. Ca. 50 % des produzierten technischen Siliciums verwendet man als Legierungsbestandteil für Aluminium oder zur technischen Herstellung von Siliciumverbindungen, z. B. als Ausgagngsstoff für Silicone. |
| 3. | Reinstsilicium (Halbleitersilicium) besitzt einen Reinheitsgrad von über 99,999 %). Es wird in einem aufwendigen Reinigungsverfahren aus technischem Silicium gewonnen. Durch eine Chlorierung werden das Silicium und die anderen Elemente als Verunreinigungen in ihre Chloride überführt. Der Siedepunkt des Siliciumtetrachlorids liegt weit unterhalb der Siedepunkte der anderen Chloride bei 57 °C. Es kann daher leicht mit sehr hoher Reinheit von den anderen Chloriden abdestilliert werden, um daraus dann Reinstsilicium zu gewinnen. Hochreines Silicium leitet den elektrischen Strom bei Raumtemperatur nicht. Erst durch die gezielte Einführung geeigneter Fremdatome, z. B. Aluminium-, Arsen- oder Antimon, erhält man das halbleitende Silicium. Diesen Vorgang nennt man Dotierung. Das dotierte Silicium wird in der Computerindustrie für die Chipherstellung und in der Solartechnik zur Produktion von Solarzellen benötigt. |
Silicium-Sauerstoffverbindungen
Siliciumdioxid ist das einzige stabile Oxid des Siliciums. Es liegt anders als Kohlenstoffdioxid nicht als einzelnes Molekül vor. Das liegt daran, dass das Siliciumatom deutlich größer als das Kohlenstoffatom ist und deshalb mehr als zwei Bindungspartner anlagert. Anstelle von zwei Doppelbindungen werden vom Silicium vier Einfachbindungen zum Sauerstoff ausgebildet, sodass eine räumliche Struktur entsteht. Das Siliciumatom ist tetraedrisch über Sauerstoffatome mit weiteren Siliciumatomen verknüpft, sodass ein Gitter mit der Verhältnisformel SiO2 entsteht. (Bild 5).
-
Siliciumdioxid ist fest, kristallin, in reiner Form farb- und geruchlos.
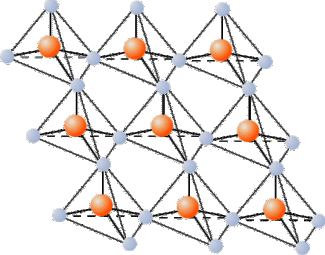
Siliciumdioxid kommt in der Natur als Quarz in verschiedenen Erscheinungsformen vor. Am bekanntesten sind Quarzsand oder Seesand. Verschiedene Mineralien, z. B. Granit, enthalten Quarz. Als Bergkristall findet man reines Siliciumdioxid in Gesteinshöhlen (Bild 6). Spuren von anderen Metallen führen zu Verfärbungen, so entsteht die violette Färbung von Amethystquarz durch Eisenspuren. Siliciumdioxid und die Silicate sind die Hauptbestandteile der in der Erdkruste enthaltenen Sande und Gesteine.
Aufgrund der großen Härte der Kristalle ist Quarz als Schleifmittel, z. B. als Scheuersand, einsetzbar.
Extrem feinkörniges Siliciumdioxid, das sogenannte Kieselgel, welches nach speziellen Verfahren hergestellt wird, dient als Verdickungsmittel in Dichtungsmassen, Farben oder Zahnpasta.
Die aus dem Siliciumdioxid abgeleitete Säuren nennt man Kieselsäuren.
Der einfachste Vertreter die Mono- bzw. Orthokieselsäure (Bild 7) ist eine sehr schwache Säure, die nur in großer Verdünnung (c< 3 • 10-3 mol • l-1) einige Zeit beständig ist.
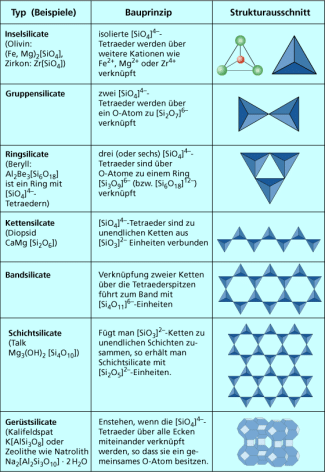
Durch Wasserabspaltung können diese Monomere zu Polykieselsäuren kondensieren. Dabei bilden sich Ketten oder Ringe, die aus tetraederförmigen -Einheiten bestehen, welche über Sauerstoffatome auf verschiedene Weise miteinander verknüpft sein können. Bei zweidimensionaler Vernetzung der Kieselsäure entstehen Schichtstrukturen unterschiedlicher Größe. Entsprechend vielfältig sind die Strukturen der entsprechenden Salze, der Silicate. Je nach Verknüpfung der Monosilicattetraeder können Silicate kettenförmig, flächig (Blattsilicate oder Schichtsilicate) oder räumlich (Gerüstsilicate) aufgebaut sein (Bild 8). Mit der Vielfalt der Strukturen ändern sich die Eigenschaften, sodass Silicate viele technische Anwendungen haben. Tonmineralien, die für keramische Erzeugnisse eingesetzt werden, sind Schichtsilicate. Da sich zwischen den Schichten Wasser einlagern kann, quillt Ton beim Anfeuchten und schwindet beim Brennen.
-
Aufbau der Mono- bzw. Orthokieselsäure

Sand wird zur Glasherstellung benötigt. Der vielseitige Werkstoff Glas besteht zu großen Teilen aus Siliciumdioxid oder Silicaten. Zur Herstellung werden die Rohstoffe (Sand, Natrium- und Calciumcarbonat sowie Metalloxide) sehr fein gemahlen und miteinander vermengt. Bei Temperaturen von 1 000-1 200 °C wird das Gemisch geschmolzen und die Rohstoffe vereinigen sich zu flüssigem Glas. Die Schmelze wird aus dem Schmelzofen entnommen und nach der Verarbeitung (Formgebung) so schnell abgekühlt, dass der glasartige Zustand erhalten bleibt, d. h. die einzelnen Komponenten nicht auskristallisieren können.
Alkalisilicate (Natrium- und Kaliumsilicate) werden für Betonimprägnierungen und als Bindemittel für Mauerputze sowie zur Herstellung von Wasch- und Reinigungsmitteln verwendet. Zeolithe und andere Gerüstsilicate weisen eine porenreiche Struktur auf, in der kleine Moleküle oder Ionen gebunden werden können. Deshalb setzt man diese Silicate vielfach als Katalysatoren für technische Prozesse ein.
-
Einteilung der Silicate nach ihrer Struktur
Weitere Siliciumverbindungen
Die Silicium-Wasserstoff-Verbindungen, Silane, der allgemeinen Zusammensetzung sind weniger stabil als die vergleichbaren Kohlenstoff-Wasserstoff-Verbindungen, die Alkane der Zusammensetzung . Silane werden durch Luftsauerstoff sehr leicht oxidiert und haben nur geringe technische Bedeutung.
Siliciumcarbid ist ein wichtiger Vertreter der keramischen Werkstoffe. Wie Silicium und Kohlenstoff kristallisiert es im Diamantgitter weist ähnliche Eigenschaften wie der Diamant auf. Die hohe chemische Beständigkeit sowie die hohe Festigkeit und Härte auch bei hohen Temperaturen (über 1 000°C), machen das Siliciumcarbid zu einem modernen Werkstoff. Auch aus Siliciumnitrid werden keramische Werkstoffe hergestellt. Die Nitride haben ähnliche Eigenschaften wie Siliciumcarbid-Keramiken. Die Hochleistungskeramiken werden als Materialien für stark belastete Bauteile im Maschinenbau, Dichtungen in Pumpen oder für medizinische Implantate eingesetzt.
Die wichtigsten Siliciumhalogenide sind das Siliciumtetrachlorid und das Silicochloroform. Sie werden zur Herstellung von Reinstsilicium und organischen Siliciumverbindungen, den Siliconen eingesetzt.
Silicone sind siliciumorganische Kunststoffe. Sie sind chemisch und thermisch bis 250°C beständig und weisen eine hohe Flexibilität auf. Silicone finden sich in nahezu allen Bereichen des täglichen Lebens. Sie werden zur Abdichtung von Fugen im Sanitärbereich und zur Imprägnierung von Textilien genutzt (Bild 9). Sie sind Bestandteil von Schmiermitteln (Silikonspray), Lacken und Waschmitteln, können aber auch Kabelummantelung in der Elektroindustrie verwendet werden.

